
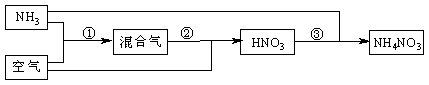
某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
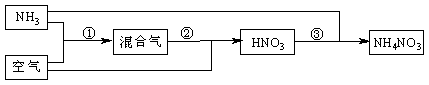
其中反应①为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(1)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为_____________________________________。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨
(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?(要求写出解题过程)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
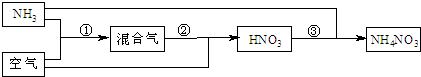
某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
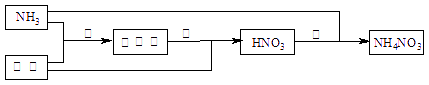
其中反应①为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
⑴步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为_____________
________________________。
⑵若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
⑶假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
其中反应①为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(1)步骤②中发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示_______
_____________________________。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为____________。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c、硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com