
| A. | 0.1mol/LH2SO4与0.2mol/L 氨水各50mL | |
| B. | 0.1mol/LCH3COOH与0.1mol/LNaOH 溶液各50mL | |
| C. | pH=1的CH3COOH与pH=13的 NaOH 溶液各50mL | |
| D. | pH=1的盐酸与 pH=13的 NaOH 溶液各50mL |
分析 A.0.1mol/LH2SO4与0.2mol/L 氨水各50mL,二者恰好反应生成硫酸铵,溶液显示弱酸性;
B.0.1mol/LCH3COOH与0.1mol/LNaOH 溶液各50mL,二者恰好反应生成醋酸钠,溶液显示弱碱性;
C.pH=1的CH3COOH与pH=13的 NaOH 溶液各50mL,醋酸为弱酸,混合液中醋酸过量,溶液显示酸性;
D.pH=1的盐酸与pH=13的NaOH溶液各50mL混合,恰好反应生成NaCl,溶液的pH=7.
解答 解:A.0.1mol/LH2SO4与0.2mol/L 氨水各50mL,硫酸和一水合氨的物质的量相等,二者恰好反应生成硫酸铵,铵根离子部分水解,溶液呈弱酸性,溶液的pH<7;
B.0.1mol/L CH3COOH与0.1mol/LNaOH 溶液各50mL,醋酸与氢氧化钠的物质的量相等,二者恰好反应生成醋酸钠,醋酸根离子部分水解,溶液呈弱碱性,溶液的pH>7;
C.pH=1的CH3COOH与pH=13的 NaOH 溶液各50mL,醋酸为弱酸,混合液中醋酸过量,溶液显示酸性,溶液的pH<7;
D.pH=1的盐酸与pH=13的NaOH溶液各50mL混合,氯化氢和氢氧化钠都是强电解质,二者恰好反应生成NaCl,溶液的pH=7;
根据以上分析可知,溶液的pH最大的为B,
故选B.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确反应后溶质组成为解答关键,注意弱电解质部分电离的特点,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 未加盐酸时:c(OH-)>c(Na+)=c(NH3•H2O) | B. | 加入10mL盐酸时:c(NH4+)+c(H+)=c(OH-) | ||
| C. | 加入盐酸至溶液pH=7时:c(Cl-)=c(Na+) | D. | 加入20mL盐酸时:c(Cl-)=c(NH4+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中一定含有化学键 | |
| B. | 共价化合物一定不含有离子键 | |
| C. | 含有金属元素的离子一定是阳离子 | |
| D. | 非金属元素的化合物一定不含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述弱酸溶液的 pH=4 | |
| B. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH=7 | |
| C. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH>7 | |
| D. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液的物质的量浓度/mol•L-1 | 电离度/% | H+的物质的量浓度/mol•L-1 | pH |
| 0.1 | 2α | c1 | x |
| c | α | 2c1 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
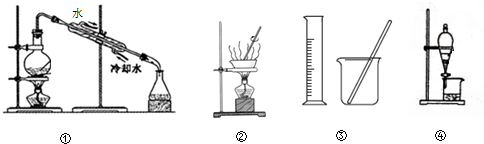
| A. | 用①分离NaCl溶液和NaOH溶液 | |
| B. | 用②蒸干NH4Cl和饱和溶液获取NH4Cl晶体 | |
| C. | 用③配制100mL 0.1000mol•L-1 K2Cr2O2溶液 | |
| D. | 用④分离Na2CO3溶液和CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
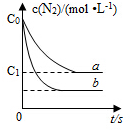 等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),下图曲线a表示该反应在T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )
等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),下图曲线a表示该反应在T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )| A. | T℃时,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| B. | T℃时,随着反应的进行,混合气体的密度减小 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com