
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中滴加2滴①KSCN溶液 | ②两份溶液都变血红色 | 生成物中都有FeCl3 |
| 分别向A、B溶液中滴加几滴KMnO4溶液 | 两份溶液颜色均无明显变化 | 生成物中都不含③FeCl2 |
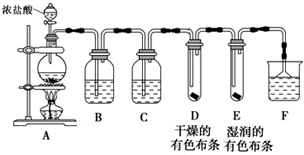
分析 (1)根据实验装置图可知,A装置中用浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,B装置中用饱和食盐水除去氯化氢,再用C装置中浓硫酸干燥,将干燥的氯气通入D装置中干燥的有色布条,再通入E装置中湿润的有色布条,再用F装置中的氢氧化钠溶液吸收氯气尾气,要用防倒吸装置,据此答题;
(2)三价铁离子遇到硫氰酸根显红色;高锰酸钾具有氧化性,可以将亚铁离子氧化为三价铁离子,溶液的颜色会发生变化,如果没有变化说明没有亚铁离子生成,则铁与氯气反应生成氯化铁,据此书写化学方程式;
解答 解:(1)根据实验装置图可知,A装置中用浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,B装置中用饱和食盐水除去氯化氢,再用C装置中浓硫酸干燥,将干燥的氯气通入D装置中干燥的有色布条,再通入E装置中湿润的有色布条,再用F装置中的氢氧化钠溶液吸收氯气尾气,要用防倒吸装置,
①根据装置图可知,盛装浓盐酸的仪器的名称是 分液漏斗,烧瓶中发生的反应为浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的化学方程式为 MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为:分液漏斗; MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
②根据上面的分析可知,B中盛有饱和食盐水,其作用是 除去Cl2中混有的HCl,C中盛装的试剂是浓硫酸,
故答案为:除去Cl2中混有的HCl;浓硫酸;
③通入Cl2后,D中布条不褪色,E中布条褪色,根据现象可得出的结论是 干燥的Cl2没有漂白性,
故答案为:中布条不褪色,E中布条褪色;干燥的Cl2没有漂白性;
④F中盛有NaOH溶液,其作用是 吸收氯气,防止环境污染,若有2.24L(标准状况下)即0.1molCl2被NaOH溶液完全吸收,根据反应方程式Cl2+2OH-=Cl-+ClO-+H2O可知,反应过程中转移的电子为0.1mol,
故答案为:吸收氯气,防止环境污染;0.1;
(2)三价铁离子遇到硫氰酸根显红色,所以分别向A、B溶液中滴加2滴KSCN溶液,两份溶液都变血红色,说明生成物中都有FeCl3,高锰酸钾具有氧化性,可以将亚铁离子氧化为三价铁离子,溶液的颜色会发生变化,如果没有变化说明没有亚铁离子生成,所以分别向A、B溶液中滴加几滴KMnO4溶液,两份溶液颜色均无明显变化,说明生成物都不含有FeCl2,铁与氯气反应的方程式为 2Fe+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2FeCl3 ,
故答案为:①KSCN;②两份溶液都变血红色;③FeCl2;④2Fe+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2FeCl3 .
点评 本题考查学生对性质实验方案设计题的掌握,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,注意铁离子和亚铁离子的性质的灵活运用,侧重实验基本能力和基础知识的考查.


科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,MnO2是负极 | |
| B. | 电解质是KOH溶液 | |
| C. | 锌发生氧化反应,MnO2发生还原反应 | |
| D. | 它的能量和储存时间比普通锌锰电池高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
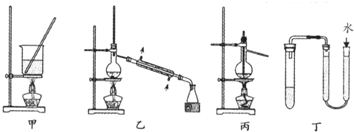
| A. | 用甲装置将海带灼烧成灰 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 利用丙装置进行石油分馏 | |
| D. | 利用丁装置检验装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | H2SO4 | C. | CH3COONa | D. | KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体的分子个数之比为17:16 | |
| B. | 同温同压下,两种气体的体积之比为17:16 | |
| C. | 两种气体的氢原子个数之比为17:12 | |
| D. | 同温同压下,两种气体的密度之比为17:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢铵溶液中加入足量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| D. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O═HClO+HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com