
| A. | 在蒸馏装置中,温度计水银球的位置在蒸馏烧瓶的支管口处. | |
| B. | “苯甲酸的重结晶”实验步骤是:加热溶解---趁热过滤---冷却结晶---滤出晶体 | |
| C. | 在萃取实验中,溶质在萃取剂中的溶解度小于在原溶剂中的溶解度 | |
| D. | 在过滤实验中,应做到“一贴,二低,三靠” |
分析 A.蒸馏时,温度计用于测量馏分的温度;
B.苯甲酸的溶解度随温度变化较大,趁热过滤可减少苯甲酸的损失;
C.萃取实验时,溶质在萃取剂中的溶解度较大;
D.过滤时应尽量保证将固体滤去,且防止滤液浑浊.
解答 解:A.蒸馏时,温度计水银球的位置在蒸馏烧瓶的支管口处,用于测量馏分的温度,故A正确;
B.苯甲酸的溶解度随温度变化较大,趁热过滤可除去杂质,杂质残留在母液中,冷却可得到晶体,故B正确;
C.萃取实验时,溶质在萃取剂中的溶解度较大,故C错误;
D.过滤时,一贴:即使滤纸润湿,紧贴漏斗内壁,不残留气泡. (防止气泡减慢过滤速度.);二低:1.滤纸边缘略低于漏斗边缘. 2.液面低于滤纸边缘.(防止液体过滤不净.);三靠:1.盛过滤液的烧杯紧靠玻璃棒. 2.玻璃棒下端靠三层滤纸处. 3.漏斗下端管口紧靠烧杯内壁.故D正确.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、实验基本操作等,把握物质的性质、实验技能为解答的关键,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
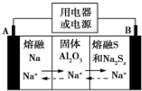 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体 Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体 Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 电子流向:A电极→用电器→B电极→电解质→A 电极 | |
| B. | 充电时,电极B与外接电源正极相连,电极反应式为Sx2--2e-=xS | |
| C. | 若用该电池在铁器上镀锌,则铁器应与B电极相连接 | |
| D. | 若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:| 化学键 | N≡N键 | O=O键 | N$\stackrel{←}{=}$O键 |
| 键能kJ/•mol-1 | 945 | 498 | 630 |
| 0min | 5min | 10min | 15min | 20min | |
| c(NO2) | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2) | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 熔点℃ | 沸点℃ | 密度g•cm-3 | 水溶性 |
| A | -98 | 57.5 | 0.93 | 可溶 |
| B | -84 | 97 | 0.90 | 可溶 |
| A. | 萃取 | B. | 升华 | C. | 分馏 | D. | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol NaCN中含共价键数为0.3NA | |
| B. | 0.1 mol/L NaHCO3溶液HCO3-的数目小于0.1NA | |
| C. | 19 g H218O2含有的中子数为12NA | |
| D. | 上述反应中,当有2.24 L NH3生成时,转移电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com