
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.S的燃烧热为297.23kJ/mo1 |
| B.S(g)+O2(g)===SO2(g)放出的热量大于297.23kJ |
| C.S(g)+O2(g)==SO2(g)放出的热量小于297.23kJ |
| D.形成1mol SO2(g)的化学键所释放的总能量大于断裂1molS(s)和lmolO2(g)的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1+Q2+Q3 | B.0.5(Q1+Q2+Q3) | C.0.5Q1-1.5Q2+0.5Q3 | D.1.5Q1-0.5Q2+0.5Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
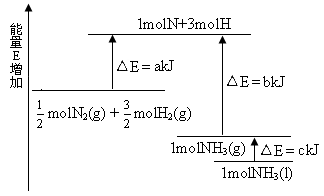
| A.N2(g)+3H2(g) ="==" 2NH3(1)△H=2(a-b-c)kJ·mol-1 |
| B.N2(g)+3H2(g) ="==" 2NH3(g)△H=2(b-a)kJ·mol-1 |
C.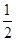 N2(g)+ N2(g)+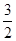 H2(g) ===NH3(1)△H=(b+c-a)kJ·mol-1 H2(g) ===NH3(1)△H=(b+c-a)kJ·mol-1 |
D.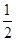 N2(g)+ N2(g)+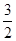 H2(g) ===NH3(g)△H=(a+b)kJ·mol-1 H2(g) ===NH3(g)△H=(a+b)kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g); ΔH1
CH3OH(g); ΔH1 CH3OH(g) +H2O(g);ΔH2
CH3OH(g) +H2O(g);ΔH2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
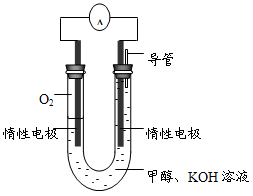
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a > b | B.a = b | C.a < b | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com