
【题目】工业上通过电解饱和的食盐水来制取氯气.现取500ml含NaCl为11.7g的饱和食盐水进行电解,
2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
在标准状况下制得Cl2多少升?所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
【答案】2.24L 0.4mol/L
【解析】解:11.7g NaCl的物质的量为 ![]() =0.2mol
=0.2mol
2NaCl+2H2O | 2NaOH+H2↑+ | Cl2↑ |
2 | 2 | 1 |
0.2mol | n(NaOH) | n(Cl2) |
所以n(Cl2)= ![]() =0.1mol
=0.1mol
n(NaOH)= ![]() =0.2mol
=0.2mol
则标况下生成氯气体积为0.1mol×22.4L/mol=2.24L,
所得NaOH的物质的量浓度为 ![]() =0.4mol/L,
=0.4mol/L,
答:在标准状况下制得Cl2为2.24L,所得NaOH的物质的量浓度为0.4mol/L.
根据公式![]() 计算11.7 gNaCl的物质的量,再根据2NaC~2NaOH~Cl2计算产生氯气、NaOH的物质的量。结合公式
计算11.7 gNaCl的物质的量,再根据2NaC~2NaOH~Cl2计算产生氯气、NaOH的物质的量。结合公式![]() 计算氯气的体积;结合公式
计算氯气的体积;结合公式![]() 计算所得NaOH的浓度。
计算所得NaOH的浓度。


科目:高中化学 来源: 题型:
【题目】如表是甲、乙、丙、丁四种有机物的有关信息;
甲 | ①能使溴的四氯化碳溶液褪色;②产量是衡量国家石油化工水平的重要标志; ③能与水在一定条件下反应生成丙 |
乙 | ①由C、H两种元素组成;②球棍模型为 |
丙 | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与丁反应生成戊 |
丁 | ①由C、H、O三种元素组成;②球棍模型为 |
根据表中信息回答下列问题:
(1)写出实验室制备甲的化学方程式;
(2)乙与液溴反应的化学方程式为;
(3)丙与丁反应能生成戊,戊为相对分子质量为100的酯,该反应类型为 , 其化学反应方程式为;
(4)写出符合下列条件的戊的同分异构体的结构简式:;
I.分子中存在两个相同甲基并能使溴的四氯化碳溶液褪色
II.能与NaHCO3溶液发生反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1,A是淡黄色固体,B的焰色反应为黄色,C是目前使用最多的半导体. 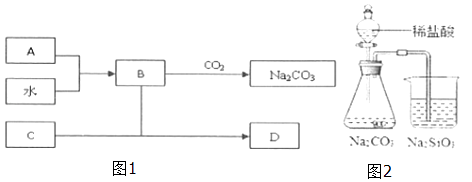
(1)A的化学式为 , 为何盛装B溶液的试剂不能用磨口玻璃塞,请用化学方程式解释 .
(2)D的水溶液呈性,将过量CO2通入D溶液中,现象为 .
(3)为证明酸性:碳酸>硅酸,有同学设计如图2实验装置:请指出该装置中不合理之处 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃0.1mol完全燃烧时生成11.2L CO2(标况下),则其化学式是_________。则该烷烃的结构简式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5molL﹣1的某澄清溶液中,还可能含有下表中的若干种离子.
(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
阴离子 | NO | CO | SiO | SO |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)实验Ⅰ能确定一定不存在的离子是;
(2)实验Ⅰ中生成气体的离子方程式为;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
阴离子 | NO | CO | SiO | SO |
c/molL﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属晶体堆积密度大,原子配位数高,能充分利用空间的原因是( )
A.金属原子的价电子数较少
B.金属晶体中存在自由移动的电子
C.金属晶体的原子半径较大
D.金属键不具有方向性和饱和性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2 4种物质的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失;丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是
A.Al2(SO4)3 B.NaOH C.BaCl2 D. FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.金属键无方向性和饱和性,原子配位数较高
B.晶体尽量采取紧密堆积方式,以使其变得比较稳定
C.因为共价键有饱和性和方向性,所以原子晶体不遵循“紧密堆积”原理
D.金属铜和镁均以ABAB……方式堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
(1)【实验方案一】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量.实验中发生反应的化学方程式是 【实验步骤】
称取5.4g铝镁合金粉末样品,溶于VmL 2.0mol/LNaOH溶液中,充分反应.则NaOH溶液的体积V≥ .
(2)过滤、洗涤、干燥、称量固体.该步骤中若未洗涤固体,测得镁的质量分数将(填“偏高”、“偏低”或“无影响”).
(3)【实验方案二】 将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01105Pa)的体积.
【问题讨论】
同学们拟选用图1实验装置完成实验: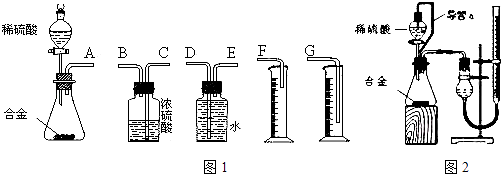
①你认为最简易的装置其连接顺序是:A接接接(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因. .
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 .
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平,读取量筒中水的体积
(4)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置. ①装置中导管a的作用是 .
②实验前后碱式滴定管中液面读数分别为V1mL、V2mL.则产生氢气的体积为mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com