
【题目】(题文)工业上用铝土矿(主要成分为A12O3,还有少量的Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
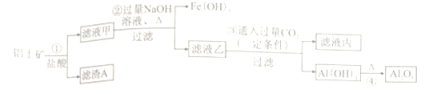
下列说法错误的是
A. 滤渣A主要成分为SiO2
B. 滤液乙含有的阴离子主要为[Al(OH)4]-、Cl-、OH-
C. 滤液丙中溶质的主要成分为Na2CO3
D. ④的基本反应类型为分解反应
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物分子的比例模型示意图。下列说法正确的是( )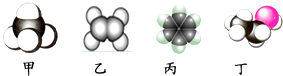
A.甲是甲烷,甲烷的二氯取代产物只有一种结构
B.乙是乙烯,乙烯可与溴水发生取代反应使溴水褪色
C.丙是苯,苯结构比较稳定,不能发生氧化反应
D.丁是乙酸,一定条件下乙酸能跟乙醇发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的说法正确的是
A.有人设想通过特殊的方法将碳酸钙加工成为纳米碳酸钙,纳米碳酸钙是与胶体相似的分散系
B.氢氧化铁胶体、葡萄糖溶液用激光笔照射,均能观察到一条光亮的通道
C.明矾溶于水能形成胶体,可用于自来水的杀菌消毒
D.胶体的分散质粒子能通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,以制取乙酸乙酯。
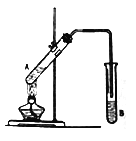
(1)试管A中的液体由以下试剂混合而成:①2mL乙醇;②3mL浓硫酸;③2mL 乙酸。一般况下,这三种试剂的加入顺序是:先加入________(填序号,下同),再加入_________,最后加入③。
(2)为防止试管A中的液体在实验时发生暴沸,在加热前还应加入碎瓷片。若加热后发现未加入碎瓷片,应采取的补救措施是:_________________________________________________________。
(3)试管B中盛放的试剂是___________________;反应结束后,分离B中的液体混合物需要用到的玻璃仪器主要是_____________。试管B中的导管末端不伸入液面下方的目的是_______________。
(4)试管 A中CH3COOH与C2H518OH反应的化学方程式为:___________________________________。
(5)该实验中用30gCH3COOH与46gC2H5OH反应,如果实际得到的乙酸乙酯的质量是26.4g,该实验中乙酸乙酯的产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取含Cr2O72-的模拟水样若干份,在不同pH条件下,分别向每个水样中加一定量的FeSO4或NaHSO3固体,充分反应后再滴加碱液生成Cr(OH)3沉淀,从而测定除铬率,实验结果如图所示。下列说法正确的是
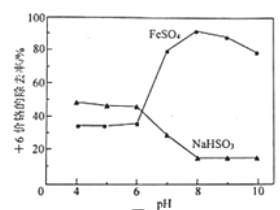
A. 理论上FeSO4的除铬率比等质量的NaHSO3高
B. 用NaHSO3除铬时,pH越低,越有利于提高除铬率
C. pH>8,FeSO4的除铬率下降与废水中溶解氧参与反应有关
D. 从提高除铬率的角度分析,处理酸性含铬废水应选用NaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列化学方程式或离子方程式。
(1)利用铝热反应焊接钢轨的化学方程式为_________________________。
(2)实验室利用二氧化锰和浓盐酸制取氧气的化学方程式为__________________。
(3)乙醇与金属钠反应的化学方程式为___________________________。
(4)苯与浓硫酸和浓硝酸混合液共热制取硝基苯的化学方程式为__________________。
(5)氯化铝溶液与氨水制备氢氧化铝的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B3N3H6与C6H6是等电子体,则下列说法不正确的是( )
A. B3N3H6能发生加成反应和取代反应 B. B3N3H6具有碱性
C. B3N3H6各原子在同一平面上 D. B3N3H6不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
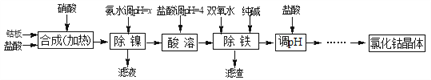
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式 | 沉淀完全时的pH | 钴镍性质 |
Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
Fe(OH)2 | 9.6 | |
Fe (OH)3 | 3.7 |
(1)“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=_______时,除镍效果最好。
加NH3·H2O调pH | 收率/% | Ni2+含量/% |
9 | 98.1 | 0.08 |
9.5 | 98 | 0.05 |
10 | 97.6 | 0.005 |
10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是________________________。
(4)“除铁”步骤中加入的纯碱作用是_______________________________。
(5)在“调pH”步骤中,加盐酸的作用是______________________________。
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为_____________________。
Fe(OH)3+3H+的平衡常数为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com