
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A. | 反应在前2 s 的平均速率v(O2)=0.4 mol•L-1•s-1 | |
| B. | 保持其他条件不变,体积压缩到1.0 L,平衡常数将增大 | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大 |
分析 A.先计算三氧化硫反应速率,再根据同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比计算v(O2);
B.化学平衡常数只与温度有关,温度不变,化学平衡常数不变;
C.相同温度下,起始时向容器中充入4mol SO3,如果三氧化硫完全转化为二氧化硫和氧气,二氧化硫和氧气的物质的量分别是4mol、2mol,为原来的2倍,增大压强平衡正向移动,则二氧化硫转化率增大;
D.根据压强对化学平衡的影响分析.
解答 解:A.根据表格中数据知,当n(SO3)=1.8mol,该反应达到平衡状态,反应在前2s的平均速率v(SO3)=$\frac{\frac{0.8mol}{2L}}{2s}$=0.2mol•L-1•s-1,同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,v(O2)=$\frac{1}{2}$×0.2mol•L-1•s-1=0.1mol•L-1•s-1,故A错误;
B.化学平衡常数只与温度有关,温度不变,化学平衡常数不变,与压强、物质浓度都无关,故B错误;
C.相同温度下,起始时向容器中充入4mol SO3,如果三氧化硫完全转化为二氧化硫和氧气,二氧化硫和氧气的物质的量分别是4mol、2mol,为原来的2倍,增大压强平衡正向移动,则二氧化硫转化率增大,所以二氧化硫转化率大于90%,相同温度下,起始时向容器中充入4mol SO3,达到平衡时,SO3的转化率小于10%,故C错误;
D.温度不变,向该容器中再充入2mol SO2、1mol O2,增大了压强,平衡正向移动,三氧化硫的物质的量增加,氧气的物质的量减小,所以比值增大,故D正确;
故选D.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握化学反应速率与化学计量数的关系,试题培养了学生的分析能力及化学计算能力.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2 NA | |
| B. | 2.24LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| C. | 78g苯含有C=C双键的数目为3NA | |
| D. | 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放还原铁粉 | |
| B. | 天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点 | |
| C. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 | |
| D. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b和c分别与a形成化合物的相对分子质量一定为b>c | |
| B. | a和d形成的化合物与水反应产生的气体可做燃料 | |
| C. | +6价的c和a、b形成离子化合物 | |
| D. | a、b、c和d四种元素组成的化合物的水溶液加入少量Na2CO3只产生气体,不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
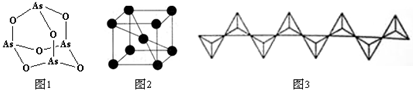
 (R、R′可表示烃基或氢原子)
(R、R′可表示烃基或氢原子)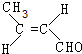 ,该分子中最多有9个原子共平面.
,该分子中最多有9个原子共平面. $→_{△}^{NaOH}$
$→_{△}^{NaOH}$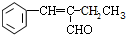 +H2O.
+H2O.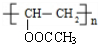 .
.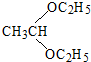 .合成路线流程图示例如下:
.合成路线流程图示例如下: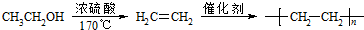
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X最高价氧化物对应的水化物为强酸 | |
| B. | 原子半径大小顺序为M>W>X>Y>Z | |
| C. | 水溶液中Z 的简单单核离子能促进水的电离 | |
| D. | Z、M的最高价氧化物对应的水化物均能溶解W与X形成的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com