
【题目】下列说法正确的是
A. 硫离子的结构示意图:![]()
B. 23Na、24Mg两种核素的中子数相等,因此互为同位素
C. CH3COOH的电离方程式为:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
D. 16O、1H、2H、3H四种核素可构成4种水分子
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】某化学小组做完高温下铁与水蒸气反应的实验后得到一种黑色粉末。他们为探究该黑色粉末中是否有未反应完的铁粉,又进行了如下实验,装置如图1所示。请回答下列问题:
(1)铁与水蒸气反应的化学方程式是_____________________;
(2)按图1连接好仪器后,检查装置的气密性的操作方法是_______________;
(3)仪器b的名称是_____,往仪器b中加入的试剂可能是______(填一种);
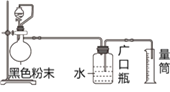
(4)实验中观察到烧瓶中有气泡产生,则黑色粉末中_______(填“有”或“无”)铁粉,产生气泡的离子方程式是________________________;
(5)如果黑色粉末的质量为w g,当时实验条件下产生的气体的密度为ρg/cm3 ,多次试验求出量筒中液体平均体积为a mL,则黑色粉末中铁的氧化物的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用苯和1,2—二氯乙烷制联苄的反应原理如下
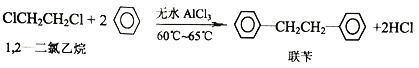
实验室制取联苄的装置如图所示(加热和夹持仪器略去)
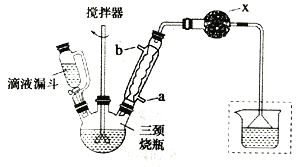
实验步骤:
①在三颈烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反应温度在60~65℃,反应约60min。
②将反应后的混合物依次用2%Na2CO3溶液和水洗涤,在所得产物中加入少量无水MgSO4固体,静置、过滤,蒸馏收集一定温度下的馏分,得联苄18.2g。
相关物理常数和物理性质如下表:
名称 | 相对分子质量 | 密度/g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶于水,易溶于乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶于水,可溶于苯 |
联苄 | 182 | 0.98 | 52 | 284 | 难溶于水,易溶于苯 |
(1)和普通分液漏斗相比,使用滴液漏斗的优点是_______________________;球形冷凝管进水口是____________(选填“a”或“b”)
(2)仪器X的名称是________________;装置中虚线部分的作用是____________。
(3)洗涤操作中,用2%Na2CO3溶液洗涤的目的是___________;水洗的目的是____________。
(4)在进行蒸馏操作时,应收集____________℃的馏分。
(5)该实验中,联苄的产率约为____________%(小数点后保留两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①~⑨是几种有机物的名称或化学式:
①2,2,3﹣三甲基丁烷、②3﹣甲基﹣1﹣氯戊烷、③甲苯、④![]() 、 ⑤ClCH=CHCl、⑥
、 ⑤ClCH=CHCl、⑥![]() ⑦
⑦ ⑧
⑧ ⑨1,3,5﹣庚三烯
⑨1,3,5﹣庚三烯
据此回答下列问题:
(1)上述有机物中,互为同分异构体的是______(用编号表示),存在顺反异构的是______(用编号表示).
(2)以③有机物为原料制备TNT炸药的化学方程式为______.
(3)已知在有机物分子中,若某个碳原子上连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”,如 中带*的C原子。[若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在。]⑨1,3,5﹣庚三烯的众多链烃同分异构体中:含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的______种.含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是____.
中带*的C原子。[若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在。]⑨1,3,5﹣庚三烯的众多链烃同分异构体中:含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的______种.含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4种相邻主族短周期元素的相对位置如表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性。回答下列问题:
![]()
(1)元素X在周期表中的位置是第________周期、第________族,其单质可采用电解熔融________的方法制备。
(2)M、N、Y三种元素最高价氧化物对应的水化物中,酸性最强的是____________,碱性最强的是______。(填化学式)
(3)气体分子(MN)2的电子式为___________。(MN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1905年,德国人哈伯发明了工业合成氨技术,其反应方程式是N2(g)+3H2(g)![]() 2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是
2NH3(g) △H<0。下图是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。下列说法正确的是

A. L代表的是压强,且L1>L2
B. L代表的是压强,且L1<L2
C. L代表的是温度,且L1<L2
D. L代表的是温度,且L1>L2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲苯合成苯甲醛:
 ,
,
下列说法正确的是
A. 甲苯分子中所有原子都在同一平面内 B. 反应①②③的反应类型相同
C. 一氯甲苯的同分异构体有3种 D. 苯甲醇可与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是当今世界最重要的化工产品之一。
I.硫酸的各种制法。
(1)早在1000多年前,我国就已采用加热胆矾(CuSO4· 5H2O)或绿矾(FeSO4·7H2O)的方法制取硫酸。FeSO4受热分解的化学方程式:2 FeSO4![]() Fe2O3+SO2↑ +SO3↑。
Fe2O3+SO2↑ +SO3↑。
① 将FeSO4受热产生的气体通入如下图装置中,以检验产生的气体中是否含有SO3和SO2。 能说明SO2存在的实验现象是_________。

② 有同学提出虚线框内盛装NaOH溶液的装置可以换成上图右边的a装置,其中多孔玻璃球泡的作用是__________。
(2)目前工业上主要采用接触法制备硫酸,其中一步为:2SO2+O2![]() 2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
2SO3。实验室模拟该过程常用下图装置进行实验。b装置中装有浓硫酸,写出b装置的作用__________(写出两点)。
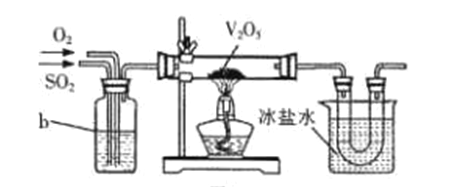
Ⅱ.硫酸的性质。
(3)下图中甲试管内发生反应的化学方程式_________ ,该反应体现了浓硫酸的性质为______。
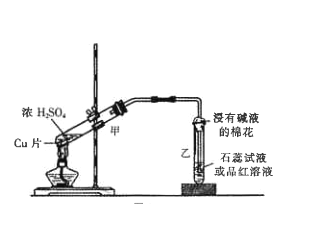
(4)当铜片与浓硫酸充分反应后,试管内并未出现蓝色溶液,而是看到白色固体,请写出检验白色固体的方法______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
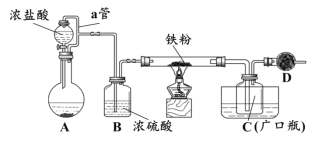
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________。仪器D的名称是__________________。
(2)D中装的药品是碱石灰,其作用是__________________________。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____(只能选取一种试剂,填序号)进行检测,实验现象是__________________________________。
①H2O2 溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com