
写出下列反应的热化学方程式:
(1)N2(g)与H2(g)反应生成1 mol NH3(g),放出46.1 kJ热量________。
(2)1 mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:
 +H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+——Mn2++CO2↑+H2O(未配平)
用4 mL 0.001 mol·L-1 KMnO4溶液与2 mL
0.01 mol·L-1 H2C2O4溶液研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究____________________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)③、④、⑦的原子半径由大到小的顺序为 (用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 (用酸的化学式表示)。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
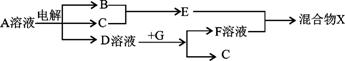
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法 。
③常温下,若电解1L0.1 mol·L-1的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 。
④写出过量的E与F溶液中溶质反应的离子方程式 。
(5)由②、④、⑥元素组成的化合物W(在酸性溶液中发黄,W还原性较强),在溶液中易被⑦的单质氧化,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.化学反应中的能量变化,都表示为热量的变化
B.需要加热才能发生的化学反应,一定是吸热反应
C.放热反应在常温下一定很容易发生
D.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.反应焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时,ΔH>0,反应吸热时,ΔH<0
C.在加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物能量大于反应产物能量时,反应放热,ΔH为“-”
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298 K时,合成氨反应N2(g)+3H2(g)===2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)( )
A.一定小于92.0 Kj B.一定大于92.0 kJ
C.一定等于92.0 kJ D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是( )
A.2SO2(g)+O2(g)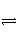
 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g)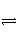
 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+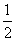 O2(g)
O2(g)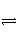
 SO3(g) ΔH=98.3 kJ·mol-1
SO3(g) ΔH=98.3 kJ·mol-1
D.SO2(g)+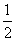 O2(g)
O2(g)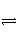
 SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
电解84.75 mL 16%的NaOH溶液(ρ=1.18 g·cm-3),用石墨作电极经过一段时间后溶液浓度为19.5%,这是因为( )
A.溶质增加了3.5 g
B.放出了22.4 L H2和11.2 L O2
C.NaOH比水消耗少
D.消耗18 g水
查看答案和解析>>
科目:高中化学 来源: 题型:
3He可以作为核聚变材料,以下关于3He的说法正确的是 ( )
A.与4He质子数相同
B.比4He多一个中子
C.与4He互为同分异构体
D.与4He互为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com