
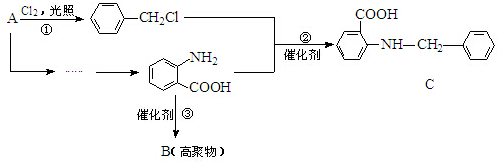
 (弱碱,易被氧化)
(弱碱,易被氧化) .
.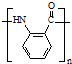 ;反应③的有机反应类型:缩聚反应.
;反应③的有机反应类型:缩聚反应. 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式:
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式: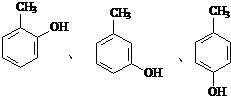 .
. →B
→B 等.
等.分析 由反应①可知A为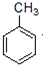 ,反应②为发生取代反应,同时生成HCl,反应③为
,反应②为发生取代反应,同时生成HCl,反应③为 发生缩聚反应生成高分子化合物
发生缩聚反应生成高分子化合物 .
.
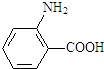
(4)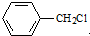 水解产物为
水解产物为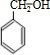 ,其同分异构体遇氯化铁溶液发生显色反,说明含有酚羟基,甲基与酚羟基有邻、间、对三种;
,其同分异构体遇氯化铁溶液发生显色反,说明含有酚羟基,甲基与酚羟基有邻、间、对三种;
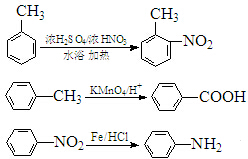
(5)由步骤Ⅲ产物结构,可知甲苯发生硝化反应生成T为 ,用高锰酸钾溶液氧化得到J为
,用高锰酸钾溶液氧化得到J为 ,用铁粉和盐酸还原硝基生成
,用铁粉和盐酸还原硝基生成 .
.
解答 解:由反应①可知A为 ,反应②为发生取代反应,同时生成HCl,反应③为
,反应②为发生取代反应,同时生成HCl,反应③为 发生缩聚反应生成高分子化合物
发生缩聚反应生成高分子化合物 .
.
(1)A为 ,名称为甲苯,故答案为:甲苯;
,名称为甲苯,故答案为:甲苯;
(2)反应②的化学方程式为: ,
,
故答案为: ;
;
(3)反应③为 发生缩聚反应生成高分子化合物B为
发生缩聚反应生成高分子化合物B为 ,
,
故答案为: ;缩聚反应;
;缩聚反应;
(4)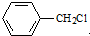 水解产物为
水解产物为 ,其同分异构体遇氯化铁溶液发生显色反,说明含有酚羟基,甲基与酚羟基有邻、间、对三种,结构简式为
,其同分异构体遇氯化铁溶液发生显色反,说明含有酚羟基,甲基与酚羟基有邻、间、对三种,结构简式为 ,
,
故答案为: ;
;
(5)由步骤Ⅲ产物结构,可知甲苯发生硝化反应生成T为 ,用高锰酸钾溶液氧化得到J为
,用高锰酸钾溶液氧化得到J为 ,用铁粉和盐酸还原硝基生成
,用铁粉和盐酸还原硝基生成 .
.
①T为 ,分子式为C7H7O2N,如果条件控制不好,可能生成副产物
,分子式为C7H7O2N,如果条件控制不好,可能生成副产物 等,
等,
故答案为:C7H7O2N; 等;
等;
②氨基易被氧化,如果先还原硝基生成氨基,后氧化甲基,高锰酸钾会氧化氨基,产生副产物,使产品纯度低,产率低,
故答案为:氨基被氧化,产品含杂质多,产率低.
点评 本题考查有机物合成与推断、同分异构体书写、有机反应方程式书写等,注意根据合成路线中有机物的结构进行分析,需要学生熟练掌握官能团的性质与转化,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ,请推测其具有的化学性质,填写下列空白:
,请推测其具有的化学性质,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
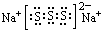 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;CO2的电子式
;CO2的电子式 ;NH4Cl的电子式
;NH4Cl的电子式 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该病毒主要通过血液向他人传染 | |
| B. | 该病毒在浓盐溶液中一定会发生变性 | |
| C. | 通常将病毒样本保存在福尔马林中 | |
| D. | 该病毒在一定条件下水解最终会生成氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为减缓反应速率,将饱和食盐水滴加到烧瓶中的电石上来制取乙炔 | |
| B. | 实验室制乙烯时应将无水乙醇缓慢加入到浓硫酸中,并加入碎瓷片以防暴沸 | |
| C. | 将浓氨水逐滴加入到2%的硝酸银溶液中至产生的沉淀恰好溶解即制得银氨溶液 | |
| D. | 苯甲酸的重结晶实验中,粗苯甲酸全溶后再加入少量蒸馏水,目的是有利于趁热过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH3COONa溶液中存在CH3COOH分子,且c(CH3COOH)大于c(CH3COO-) | |||||||||||
| B. | 将浓度为0.1 mol•L-1HF溶液加水不断稀释,c(H+)/c(HF)始终保持增大 | |||||||||||
| C. | 已知:
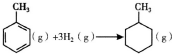 的△H为-384kJ•mol-1 的△H为-384kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的氨水中加入少量NH4Cl晶体,溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56a L | B. | (a+b)mol | C. | 56b L | D. | (a+b)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com