
| A. | X、Y、Z 一定位于同一周期 | |
| B. | X与Y形成的化合物中各原子不一定达到8电子稳定结构 | |
| C. | Y、Z的最高价氧化物对应水化物之间一定能相互反应 | |
| D. | W与X、Y形成的化合物的稳定性一定是前者大于后者 |
分析 已知25℃时,W、X形成的0.1mol/L化合物的水溶液pH=1,短周期元素只有HCl符合,则W为H元素,X为Cl元素,Z的电子层数与最外层电子数相等,应为Al元素,Y的原子半径比Al小,比Cl大,应为第三周期元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:由以上分析可知W为H元素,X为Cl元素,Z为Al元素,
A.由以上分析可知X、Y、Z都为第三周期元素,故A正确;
B.Y可能是Si、P、S,当为P时,PCl5为共价化合物,如果各原子达到8电子稳定结构,则需满足|化合价|+最外层电子数=8,P:|+5|+5=10,不满足,因此达不到8电子稳定结构,故B正确;
C.如Y为Si,则硅酸为弱酸,与氢氧化铝不反应,故C错误;
D.同周期元素从左到右元素的非金属性逐渐增强,元素的非金属性越强,对应的氢化物越稳定,故D正确.
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、元素的位置、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①:可用于吸收NH3,并防止倒吸 | |
| B. | 装置②:验证溴乙烷发生消去反应生成烯烃 | |
| C. | 装置③:观察原电池装置中电流表指针偏转 | |
| D. | 装置④:由实验现象推知酸性强弱顺序为CH3COOH>H2CO3>C6H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用还原性较强的物质做为负极,负极向外提供电子:用氧化性较强的物质作为正极,正极从外电路得到电子 | |
| B. | 盐桥中的K+会移向ZnSO4溶液,Cl-移向CuSO4溶液,使两个半电池保持中性 | |
| C. | 盐桥的引入,解决了Zn直接与CuSO4溶液反应降低原电池工作效率的问题 | |
| D. | 放电时,负极上的电子通过导线流向正极,再通过溶液中离子形成的内电路构成环路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8.8g CO2和N2O混合气体中所含的电子数为4.4NA | |
| B. | 6.72LNO2与水充分反应转移的电子数目为0.2NA | |
| C. | 1.0L1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA | |
| D. | 64g加热了的铜丝在硫黄蒸气里完全反应后,失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应6 NaBH4+2 FeCl3+18 H2O═2 Fe+6 NaCl+6 H3BO3+21H2↑可制纳米铁,该反应中每生成1 mol Fe,转移的电子数目为3NA | |
| B. | 标准状况下,22.4 L甲醇完全燃烧后生成的CO2分子数为 NA | |
| C. | 1mol氯气与过量铁反应,转移的电子数为 3NA | |
| D. | 30g甲酸甲酯与葡萄糖的混合物中含有的原子数为 4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致. | |
| B. | 加入Na2S可消除污水中Hg2+的污染 | |
| C. | 氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以它们的含量是空气质量报告的主要项目 | |
| D. | 有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到,合成A的一种途经是:CH3C≡CH+CO+CH3OH$\stackrel{Pd}{→}$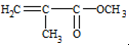 ,其过程符合绿色化学的原则 ,其过程符合绿色化学的原则 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定含有CO32- | |
| B. | 配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入盛有少量水的烧杯后,不能再用蒸馏水洗涤量筒 | |
| C. | 称量氢氧化钠固体的质量时,将称量物放在小烧杯中,并置于托盘天平的左盘,砝码放在托盘天平的右盘 | |
| D. | 向某溶液中滴加NaOH溶液,溶液中出现蓝色沉淀,该溶液中一定含Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com