
标准状况下将VLHCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质浓度为c mol/L,则下列关系中不正确的是
A.ρ=36.5c/(1000w) B.c=1000Vρ/(36.5V+22400)
C.V=22400w/[36.5(1-w)] D.ρ=(36.5V+22400)c/V
科目:高中化学 来源:2016届甘肃省高三12月月考化学试卷(解析版) 题型:选择题
如图所示的反应均是在高温后引燃后进行,选项中的物质表示A和B,不合理的是

A.MgO Al B.CO2 Mg C.Fe2O3 Al D.CuO H2
查看答案和解析>>
科目:高中化学 来源:2016届辽宁葫芦岛第一高级中学高三上期中考试化学试卷(解析版) 题型:选择题
下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是
A.K+、Ca2+、F-、NO B.K+、Ba2+、Br-、NO
C.Na+、K+、CO32-、HCO3- D.Na+、Ag+、NH3·H2O、NO
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西忻州第一中学高一上期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.氯化钠溶液在电流作用下电离成钠离子和氯离子
B.溶于水后能电离出氢离子的化合物一定是酸
C.硫酸钡难溶于水,故硫酸钡不属于电解质
D.二氧化碳溶于水能导电,但二氧化碳不属于电解质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西忻州第一中学高二上期中考试化学试卷(解析版) 题型:选择题
一定温度下,反应2SO2 + O2 2SO3,达到平衡时,n(SO2):n(O2):n(SO3) =2:3:4。缩小体积,反应再次达到平衡时,n(SO2)=0.4mol,n(SO3)=1.4mol,此时O2的物质的量应是
2SO3,达到平衡时,n(SO2):n(O2):n(SO3) =2:3:4。缩小体积,反应再次达到平衡时,n(SO2)=0.4mol,n(SO3)=1.4mol,此时O2的物质的量应是
A.0.4mol B、0.6mol C、0.8mol D、1.2mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷(解析版) 题型:推断题
下表是不同温度下水的离子积常数:
温度/℃ | 25 | T2 |
水的离子积常数 | 1×10-14 | 1×10-12 |
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是________________ ____。
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是 。
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象____________________________________,其主要原因是(用离子方程式表示) 。
(4)已知25℃时:
难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解。当加碱调节pH为 时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果和原因是 。(lg2=0.3 lg3=0.48)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北荆州中学高一上学期期中考试化学试卷(解析版) 题型:选择题
用1kg溶剂中所含溶质的物质的量表示的溶液的浓度叫质量物质的量浓度,其单位是mol/kg。某物质的溶液的质量分数为20%,质量物质的量浓度为2.358mol/kg,则该物质可能为
A.NaHCO3 B.CaCO3 C.KHCO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高二上月考三化学试卷(解析版) 题型:推断题
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
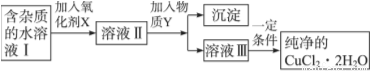
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 4 | 9.0 | 6.7 |
(1) 最适合作氧化剂X的是__________,。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)加入氧化剂的目的是_______________。
(3)加入的物质Y是___(写化学式),目的是调节溶液的pH。根据信息,溶液的pH范围应为 。
(4)当c(Fe3+)=10-5mol/L时,认为沉淀完全,则Fe(OH)3的Ksp=
(5)结合方程式和必要文字说明解释不能将溶液III直接蒸发结晶得到CuCl2·2H2O晶体的原因_____。
(6)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同 时还产生的现象有_______。
时还产生的现象有_______。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上学期10月月考化学试卷(解析版) 题型:选择题
向足量稀H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1 HCl溶液时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
A.Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-1
C.Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=-18 kJ·mol-1
D.Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=-73 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com