
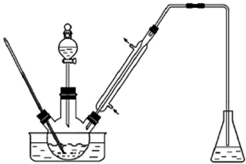
 ʵ�����Ա���ȩΪԭ���Ʊ����屽��ȩ��ʵ��װ����Ҫ������ͼ��������ʵķе��������������������ʵķе㣨101kPa��
ʵ�����Ա���ȩΪԭ���Ʊ����屽��ȩ��ʵ��װ����Ҫ������ͼ��������ʵķе��������������������ʵķе㣨101kPa��| ���� | �е�/�� | ���� | �е�/�� |
| �� | 58.8 | 1��2-�������� | 83.5 |
| ����ȩ | 179 | ���屽��ȩ | 229 |
���� ��1����ƿ�е��ܿ���Һ��Ӵ����ɷ����������л���ɸ�ʴ����ˮ�½��ϳ���ȴЧ���ã�
��2����װ�����¶ȼƻ��ɽ��������ô�¶ȼƿɲ��ˮ���¶ȣ�
��3������Ӧ����ﻺ������һ������ϡ�����У����л���ֲ㣻
��4������3����10%NaHCO3��Һϴ���ڷ�Һ©���н��У���ˮMgSO4���������ˮ��
��5���ɱ����е����ݿ�֪�����屽��ȩ�ķе�Ϊ229�棬�ɿ����¶�Ϊ200�桫250�森
��� �⣺��1��ʵ��װ���п��ܵĴ�������ƿ�ڿ��ܻᷢ���������������ܱ��л��︯ʴ�������ܽ�ˮ����a��
�ʴ�Ϊ����ƿ�ڿ��ܻᷢ���������������ܱ��л��︯ʴ��a��
��2����װ�����¶ȼƻ��ɽ��������ô�¶ȼ�Ӧ�Ƶ�ˮԡ��ʹ�ã�
�ʴ�Ϊ��ˮԡ�У�
��3������Ӧ����ﻺ������һ������ϡ�����У����л���ֲ㣬���������ǽ��衢���á���Һ��
�ʴ�Ϊ�����衢���á���Һ��
��4������3����10%NaHCO3��Һϴ�ӵľ���������ڷ�Һ©���н��л�����С�մ���Һ������ٷ�Һ���ظ��������Σ�������ˮMgSO4����������dz�ȥ�л����ˮ��
�ʴ�Ϊ���ڷ�Һ©���н��л�����С�մ���Һ������ٷ�Һ���ظ��������Σ� ��ȥ�л����ˮ��
��5���ɱ����е����ݿ�֪�����屽��ȩ�ķе�Ϊ229�棬�������ʱԤ�������¶�Ӧ��ѡ��Լ200�棬��ѡ��Լ250�棬
�ʴ�Ϊ��D��E��
���� ���⿼���л�����Ʊ�ʵ�飬Ϊ��Ƶ���㣬�����Ʊ�ԭ�����л�������ʡ����������ᴿΪ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��������ݼ����������ᴿ��Ӧ�ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 A��B��C�����ɶ�����Ԫ����ɵĵ��ʣ�D��E��F��G��H��I��Ϊ�����F�ڳ��³�ѹ��ΪҺ̬��IΪ���д��Եĺ�ɫ���壬��������ͼ��ʾ��ת����ϵ��
A��B��C�����ɶ�����Ԫ����ɵĵ��ʣ�D��E��F��G��H��I��Ϊ�����F�ڳ��³�ѹ��ΪҺ̬��IΪ���д��Եĺ�ɫ���壬��������ͼ��ʾ��ת����ϵ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
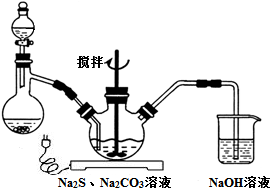
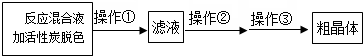
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
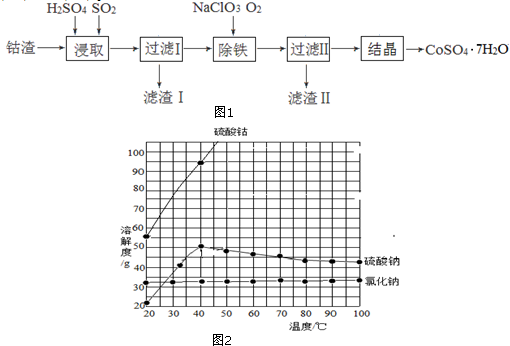
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
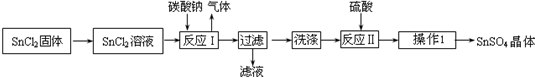
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
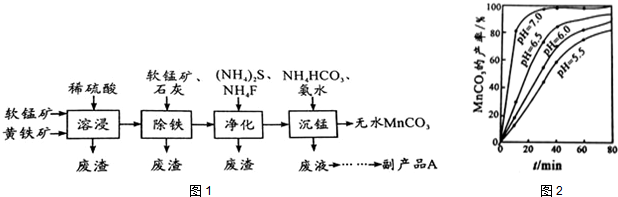
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | H2O������H-O�ļ���Ϊ462kJ?mol-1 | |
| B�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-480 kJ?mol-1 | |
| C�� | H2��ȼ����Ϊ240 kJ?mol-1 | |
| D�� | ���ֽ�2molH2O��l����������Ҫ�ṩ4��462kJ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1g98%��Ũ�����4gˮ���Ƴ�19.6%������ | |
| B�� | ����һ�����ʵ���Ũ�ȵ�������Һʱ�����ݺ��������ӵ�תҡ�Ⱥ���Һ����ڿ̶��� | |
| C�� | 10%�������90%�����������������50%��������Һ | |
| D�� | ��������Ϊ5x%��x%�����ְ�ˮ�����������Ƴ�3x%�İ�ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H2��g��+O2��g���T2H2O��l����H=-484 kJ•mol-1 | B�� | H2O��g���TH2��g��+$\frac{1}{2}$O2��g����H=+242 kJ•mol-1 | ||
| C�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-484kJ•mol-1 | D�� | 2H2��g��+O2��g���T2H2O��g����H=+484 kJ•mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com