
| A. | 用丁达尔效应可区分胶体和溶液 | |
| B. | 煤可经分馏获得洁净的燃料 | |
| C. | 非金属材料中不可以含有金属元素 | |
| D. | 电解氯化镁饱和溶液,可制得金属镁 |
分析 A.丁达尔现象是胶体特有的性质;
B.煤是固体混合物,不能分馏,分馏是分离液体混合物的操作;
C.硅酸盐材料属于无机非金属材料;
D.利用电解熔融的氯化镁来冶炼金属Mg.
解答 解:A.丁达尔现象是胶体特有的性质,溶液不能形成丁达尔效应,可用于鉴别胶体和溶液,故A正确;
B.煤是固体混合物,不能分馏,分馏是分离液体混合物的操作,煤可经干馏能获得洁净的燃料,故B错误;
C.硅酸盐材料属于无机非金属材料,如玻璃和水泥都属于无机非金属材料,它们的主要成分是硅酸盐,含有金属元素,故C错误;
D.利用电解熔融的氯化镁来冶炼金属Mg,而电解MgCl2饱和溶液生成氢氧化镁沉淀、氢气、氯气,故D错误.
故选A.
点评 本题考查物质的检验、鉴别、金属的冶炼、材料等,注重对理论与生活、生产的联系,体现了化学的学以致用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年四川省高一上教学质检化学试卷(解析版) 题型:选择题
下列说法错 误的是
误的是
A.58.5g NaCl溶于1L水中配得1mol/L NaCl溶液
B.在标准状况下,44.8LHCl气体溶于水配成1L溶液,所得溶 液中溶质的物质的量浓度为2mol/L。
液中溶质的物质的量浓度为2mol/L。
C.在标准状况下,22.4L氨气溶于水配成1L溶液,从所得溶液中取出10mL,其物质的量浓度为1mol/L。
D.1mol/L的CaCl2溶液1L,取出100mL,含0.2molCl-。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
吸热反应C+CO2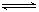 2CO反应速率为 ?1,放热反应N2+3H2
2CO反应速率为 ?1,放热反应N2+3H2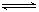 2NH3反应速率为 ?2,对于上述反应,当温度升高时,?1和
2NH3反应速率为 ?2,对于上述反应,当温度升高时,?1和 ?2的变化情况为? ?
?2的变化情况为? ?
A.同时增大  B.同时减小
B.同时减小
C.增大,减小 D.减小,增大
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 一定温度下冰转化为水是自发的化学反应 | |
| C. | 由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程 | |
| D. | 同一物质的固液气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| A. | 5.7×10-18 mol•L-1 | B. | 2.6×10-5mol•L-1 | ||
| C. | 1.6×10-13mol•L-1 | D. | 5.7×10-24mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=5的CH3COOH溶液稀释100倍 | |
| B. | 0.05mol/L H2SO4与0.10mol/L NaOH溶液以等体积混合 | |
| C. | pH=2的盐酸和pH=12的氨水两种溶液以等体积混合 | |
| D. | pH=1的H2SO4与0.10mol/L 的Ba(OH)2溶液以等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;CCH3OH;D
;CCH3OH;D ;ECH3COOH.
;ECH3COOH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com