
| A、向盐酸中滴加氨水的过程,可能满足c(H+)>c(NH4+) |
| B、0.1mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、等浓度的NaClO、NaHCO3混合溶液中:c(Na+)=c(ClO?)+c(HClO)+c(HCO3-)+c(H2CO3)+c(CO32-) |
| D、浓度均为0.1mol/L的HA(一元弱酸)和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
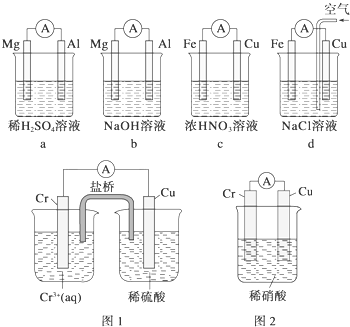 (1)分析如图所示的四个装置,回答下列问题:
(1)分析如图所示的四个装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
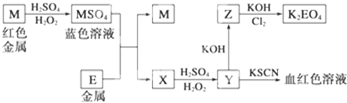
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| B、氯化亚铁溶液与过氧化钠2:1反应:6Fe2++3Na2O2+6H2O═4Fe(OH)3↓+6Na++2Fe3+ |
| C、向氧化铁中加入氢碘酸发生反应:Fe2O3+6HI═2Fe2++I2+3H2O+4I- |
| D、过量铁粉与稀HNO3反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、碳酸氢钠溶液中:c(Na+)>c(HCO
| ||||
B、常温下氨水与(NH4)2SO4溶液混合后,若溶液中c(NH4+):c(SO
| ||||
| C、硫酸铜、硫酸铝溶液与硫化钠溶液混合,都会生成氢氧化物沉淀 | ||||
| D、配制氯化铁溶液时,往往加入少量稀盐酸,并加入少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蓄电池放电时,每消耗0.1molPb,共生成0.1molPbSO4 |
| B、电解池的阴极反应式为:2H++2e-=H2↑ |
| C、电解过程中溶液中会产生白色沉淀现象 |
| D、蓄电池中每生成1molH2O,电解池中就消耗1molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
| A、上述反应是熵增反应 |
| B、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol?L-1,则此时v(正)<v(逆) |
| C、25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 |
| D、恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO的百分含量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、将容器体积变为原来2倍,CO的平衡浓度变为原来的2倍 | |||
| B、恒温恒容下,增大压强,H2浓度一定减小 | |||
| C、升高温度,逆反应速率减小 | |||
D、该反应化学方程式为CO2+H2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com