
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
分析 (1)在水溶液或者熔融状态下能够导电的化合物属于电解质;
在水溶液和熔融状态下都不能够导电的化合物属于非电解质;
物质导电的条件:含有自由电子或者自由移动的离子;
(2)H++OH-═H2O表示强酸与强碱反应生成可溶性盐和水;
(3)丁达尔效应为胶体特有性质;依据胶体聚成性质及氢氧化铁与酸发生酸碱中和反应解答;
(4)氨水为弱碱,与盐酸反应生成氯化铵,氯化铵为强碱;
(5)氢氧化钡逐滴滴加到硫酸氢钠,至恰好沉淀为止时反应生成硫酸钡、偏铝酸钠和水;
解答 解:(1)①Na2CO3•10H2O晶体,在水溶液或者熔融状态下能够导电的化合物属于电解质,不含自由电子或者自由移动的离子;
②铜为单质,既不是电解质也不是非电解质,含有自由电子,能够导电;
③氯化氢在水溶液能够导电的化合物属于电解质,不含自由电子或者自由移动的离子,不导电;
④CO2本身不能电离产生自由移动离子,不导电,属于非电解质,不含自由电子或者自由移动的离子,不导电;
⑤NaHSO4固体在水溶液或者熔融状态下能够导电的化合物属于电解质,不含自由电子或者自由移动的离子,不导电;
⑥Ba(OH)2固体在水溶液或者熔融状态下能够导电的化合物属于电解质,不含自由电子或者自由移动的离子,不导电;
⑦红褐色的氢氧化铁液体是混合物,既不是电解质也不是非电解质,含有自由移动的离子,能够导电;
⑧氨水是混合物,既不是电解质也不是非电解质,含有自由移动的离子,能够导电;
⑨稀硝酸是混合物,既不是电解质也不是非电解质,含有自由移动的离子,能够导电;
⑩熔化的Al2(SO4)3在水溶液或者熔融状态下能够导电的化合物属于电解质,含有自由移动的离子,能导电;
所以:能导电的物质:②⑦⑧⑨⑩;属于电解质:①③⑤⑥⑩;属于非电解质:④;
故答案为:②⑦⑧⑨⑩;①③⑤⑥⑩;④;
(2)H++OH-═H2O表示强酸与强碱反应生成可溶性盐和水,可以表示硝酸与氢氧化钡反应或者盐酸与氢氧化钡的反应,方程式分别为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O或Ba(OH)2+2HCl=BaCl2+2H2O,
故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O或Ba(OH)2+2HCl=BaCl2+2H2O;
(3)胶体具有丁达尔效应,可以鉴别溶液和胶体;氢氧化铁胶体中逐滴滴加硝酸,先发生聚沉,然后硝酸与氢氧化铁沉淀发生酸碱中和反应,所以现象为:先产生红褐色沉淀,后沉淀溶解;
故答案为:丁达尔效应;先产生红褐色沉淀,后沉淀溶解;
(4)氨水为弱碱,与盐酸反应生成氯化铵,氯化铵为强碱,完全电离,所以向氨水中逐滴滴加稀硝酸,离子浓度逐渐增大,导电性逐渐增强;
故答案为:由弱变强;
(5)氢氧化钡逐滴滴加到硫酸氢钠,至恰好沉淀为止时反应生成硫酸钡、偏铝酸钠和水,离子方程式:
Ba2++OH-+H++SO42-═BaSO4↓+H2O;
故答案为:Ba2++OH-+H++SO42-═BaSO4↓+H2O.
点评 本题考查了电解质、非电解质判断,离子方程式的书写,明确相关概念是解题关键,注意胶体的性质.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 压强 温度 | 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

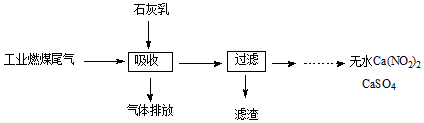
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液:HCO3-+H2O?CO32-+H3O+ | |
| B. | NaHS溶液:HS-+H2O?H2S+OH- | |
| C. | 硫酸铝溶液跟碳酸氢钠溶液反应:Al3++3HCO3-+6H2O?Al(OH)3↓+3CO2↑ | |
| D. | NH4Cl溶于D2O中:NH4++D2O?NH3HDO+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
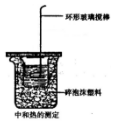 某同学用如图装置做中和热的测定实验
某同学用如图装置做中和热的测定实验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3-、Cl- | B. | Cu2+、K+、NO3- | C. | H+、HCO3-、NO3- | D. | Na+、Ba2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com