
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
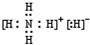 .
. 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.分析 A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;B元素原子的核外p电子数比s电子数少1,B有2个电子层,核外电子排布为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素;G在第四周期周期表的第7列,G为Mn元素.
解答 解:A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大,A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,A为H元素;B元素原子的核外p电子数比s电子数少1,B有2个电子层,核外电子排布为1s22s22p3,故B为N元素;由C原子的第一至第四电离能数据可知,第三电离能剧增,故C表现+2价,处于ⅡA族,原子序数大于N元素,故C为Mg元素;D处于第三周期,D原子核外所有p轨道全满或半满,最外层排布为3s23p3,故D为P元素;E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素;F是前四周期中电负性最小的元素,F为第四周期元素,故F为K元素;G在第四周期周期表的第7列,G为Mn元素.
(1)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为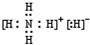 ,
,
故答案为: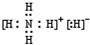 ;
;
(2)B为N元素,核外电子排布式为1s2ns2np3,基态原子中能量最高的电子,处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈纺锤形,
故答案为:3,纺锤;
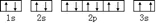
(3)某同学根据上述信息,推断C基态原子的核外电子排布为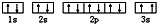 ,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利原理,
,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利原理,
故答案为:泡利原理;
(4)G为Mn元素,是25号元素,位于第四周期第ⅦB族,最后填充的为d电子,为d区元素,价电子排布式为3d54s2,
故答案为:ⅦB;d;3d54s2;
(5)PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+1=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,
故答案为:sp3;
(6)金属性越强,第一电离能越小,故第一电离能大小关系为 Mg>K,
故答案为:Mg>K.
点评 本题是对物质结构的考查,涉及结构性质与位置关系、核外电子排布规律、电离能、杂化轨道理论等,综合性较大,难度中等,推断元素是解题的关键,注意基础知识的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 酸和醇反应一定能生成酯,且酯化反应是可逆反应 | |
| B. | 实验证实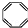 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键 | |
| C. | DDT的结构简式为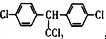 ,分子中最多有14个碳原子共平面 ,分子中最多有14个碳原子共平面 | |
| D. | 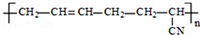 的单体是CH3-C≡C-CH3和CH2=CH-CN 的单体是CH3-C≡C-CH3和CH2=CH-CN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
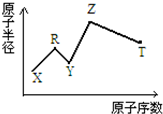 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点排序:Y>T>R | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl比H2S稳定 | B. | 常温下Cl2为气体,S单质为固体 | ||
| C. | 单质S可以在空气中燃烧Cl2不能 | D. | 溶于水时HCl是强酸而H2S是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p63s23p64s2 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p63s23p2 | D. | 1s22s22p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ③⑤⑥ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③⑤⑥⑦ | B. | ②③④⑥⑧ | C. | ①②③④⑥ | D. | ③⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com