
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

【答案】![]() 15 N sp2 氧元素的电负性大于氮,氧原子的半径小于氮,水分子间氢键比氨分子间氢键强 N2或CO 8 正四面体 12
15 N sp2 氧元素的电负性大于氮,氧原子的半径小于氮,水分子间氢键比氨分子间氢键强 N2或CO 8 正四面体 12 ![]() ×1030
×1030
【解析】
试题(1)基态氯原子的最外层有7个电子,排布在3s、3p能级上;铜原子核外有29个电子,核外电子排布为1s22s22p63s23p63d104s1;(2)同周期元素从左到右第一电离能增大,ⅤA族原子p轨道半充满,第一电离能大于ⅥA族元素的原子;CO32-中碳原子的价电子对数是![]() ;(3) 水分子间氢键比氨分子间氢键强;(4)等电子体是原子数相同、价电子数相同的微粒;单键是σ键,三键中有1个是σ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为正四面体;(5)根据晶胞图分析氯离子周围离氯离子最近的氯离子数目;晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中,r(Clˉ)=apm,所以晶胞边长是
;(3) 水分子间氢键比氨分子间氢键强;(4)等电子体是原子数相同、价电子数相同的微粒;单键是σ键,三键中有1个是σ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为正四面体;(5)根据晶胞图分析氯离子周围离氯离子最近的氯离子数目;晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中,r(Clˉ)=apm,所以晶胞边长是![]() pm,根据均摊原则,每个晶胞含有 Clˉ数是
pm,根据均摊原则,每个晶胞含有 Clˉ数是![]() ,含有Na+数是
,含有Na+数是![]() ;
;
解析:(1)基态氯原子的价电子排布在3s、3p能级上,价电子排布图是![]() ;铜原子核外有29个电子,核外电子排布为1s22s22p63s23p63d104s1,排布在15个原子轨道上,所以有15种空间运动状态;(2)同周期元素从左到右第一电离能增大,ⅤA族原子p轨道半充满,第一电离能大于ⅥA族元素的原子,所以碳、氮、氧三种元素中第一电离能最大的是N;CO32-中碳原子的价电子对数是
;铜原子核外有29个电子,核外电子排布为1s22s22p63s23p63d104s1,排布在15个原子轨道上,所以有15种空间运动状态;(2)同周期元素从左到右第一电离能增大,ⅤA族原子p轨道半充满,第一电离能大于ⅥA族元素的原子,所以碳、氮、氧三种元素中第一电离能最大的是N;CO32-中碳原子的价电子对数是![]() ,所以碳原子的杂化轨道类型为sp2 ;(3) 氧元素的电负性大于氮,氧原子的半径小于氮,水分子间氢键比氨分子间氢键强,所以水的沸点高于液氨;(4)等电子体是原子数相同、价电子数相同的微粒,所以与CNˉ互为等电子体的分子的化学式是N2或CO;单键是σ键,三键中有1个是σ键,所以1 mol[ Cu(CNˉ)4]2-中含有8molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为正四面体;(5)根据晶胞图,1个氯离子周围离氯离子最近的氯离子数目是12个;晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中,r(Clˉ)=apm,所以晶胞边长是
,所以碳原子的杂化轨道类型为sp2 ;(3) 氧元素的电负性大于氮,氧原子的半径小于氮,水分子间氢键比氨分子间氢键强,所以水的沸点高于液氨;(4)等电子体是原子数相同、价电子数相同的微粒,所以与CNˉ互为等电子体的分子的化学式是N2或CO;单键是σ键,三键中有1个是σ键,所以1 mol[ Cu(CNˉ)4]2-中含有8molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为正四面体;(5)根据晶胞图,1个氯离子周围离氯离子最近的氯离子数目是12个;晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中,r(Clˉ)=apm,所以晶胞边长是![]() pm,根据均摊原则,每个晶胞含有 Clˉ数是
pm,根据均摊原则,每个晶胞含有 Clˉ数是![]() ,含有Na+数是
,含有Na+数是![]() ;所以密度是
;所以密度是![]()
![]() ×1030 g·cm-3。
×1030 g·cm-3。


科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
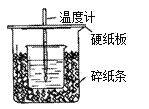
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)烧杯间填满碎纸条的作用是_______________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1的盐酸跟50 mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_____________ (填“相等”或“不相等”)。
(5)此反应中和热的热化学方程式为:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氧化钠溶液、②铜片、③碳酸钙、④蔗糖、⑤熔融的NaCl、⑥SO2气体、⑦碳酸氢钠、⑧盐酸
(1)能导电且属于电解质的是___________。(填编号)
(2)写出碳酸钙的电离方程式____________________________________。
(3)写出碳酸氢钠与氢氧化钠反应的离子方程式____________________________________。
(4)向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
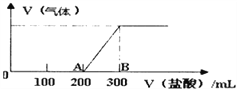
则
①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为_________(写化学式)。
②盐酸的浓度为________________________。
③B点时,产生的气体在标准状况下的体积为_________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
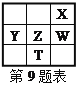
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下左图所示,根据判断出的元素回答问题:

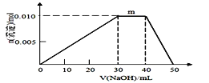
⑴ f在元素周期表的位置是__________。
⑵ 比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________
⑶ 任选上述元素组成一种四原子共价化合物,写出其电子式____________________
⑷ 已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式____________
⑸ 上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如上右图所示:
① R溶液中离子浓度由大到小的顺序是________________
② 写出m点反应的而离子方程式________________________________
③ 若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分中产生沉淀的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮可以去除油污,还可以_____________。
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是____________→ 洗涤 →__________________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是__________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。请写出酸性条件下![]() 与
与![]() 反应的离子方程式______(
反应的离子方程式______(![]() 被还原为
被还原为![]() )。
)。
(5)若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取__________g ,K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有_______ (用编号表示)。
①电子天平 ②烧杯 ③锥形瓶 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(6)若配制![]() 标准溶液时,俯视刻度线,则测定结果________(填“偏大”、“偏小”或“不变”,下同)。滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将_________ 。
标准溶液时,俯视刻度线,则测定结果________(填“偏大”、“偏小”或“不变”,下同)。滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少量KI,反应后加人CC14并振荡,有 机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 测0.1mol/L氨水的pH为11:NH3·H2O![]() NH
NH![]() +OH-
+OH-
B. 用Na2CO3处理水垢中CaSO4:CaSO4(s)+CO![]() (aq)
(aq)![]() SO
SO![]() (aq)+CaCO3(s)
(aq)+CaCO3(s)
C. 用CuCl2溶液做导电实验,灯泡发光:CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
D. 使用碱性电解质的氢氧燃料电池的正极反应式:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某兴趣学习小组设计如图装置制取SO2,研究其性质。
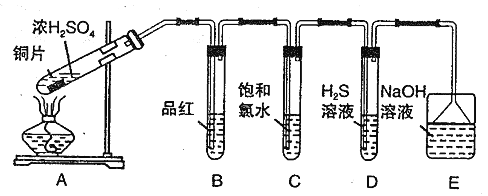
请回答下列问题:
(1)B、C、D分别用于检验SO2 的性质,写出C中反应的离子方程式_______。
(2)实验中观察到D 中有浑浊出现,有同学提出此现象不能证明SO2 具有氧化性,请简述理由________________________。
(3)E装置的作用为______________。
II.某学习小组进一步探究不同浓度的硫酸氧化性不同,设计并完成如下实验:
称取一定量还原铁粉放入一定体积浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y 中含有SO2、H2。
(4)溶液X中含有的金属阳离子是(填化学式)_________,简述如何检验该离子______。
(5)为了测定气体Y 中SO2 的含量,将2.24 L( 标准状况)气体Y 通入到200.00mL0.2000mol/L 酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗0.1000mol/L的KHC2O4标准液10.00mL (高锰酸钾被还原均生成Mn2+ )。
①已知室温下,0.1000mol/L KHC2O4 的溶液中,c(C2O42-) > c(H2C2O4)。滴定操作过程中标准液应用_______(填仪器名称)盛装;滴定终点的现象为____________。
②计算气体Y 中SO2 的物质的量分数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com