
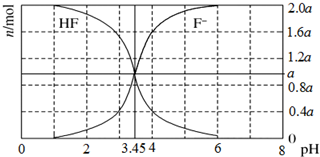
 25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol/LNaOH溶液滴定1.0L 2a mol/L氢氟酸溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | pH=3.45时,溶液中:c(Na+)+c(H+)=c(HF)+c(OH-) | |
| B. | pH=3时,溶液中:c(Na+)>c(F-) | |
| C. | n(F-)=0.6a mol时,溶液中:c(Na+)>c(HF) | |
| D. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2a mol/L |
分析 A.根据图知,pH=3.45时,溶液中c(F-)=c(HF),且该溶液中存在电荷守恒c(Na+)+c(H+)=c(F-)+c(OH-);
B.pH=3时,溶液呈酸性,溶液中存在c(H+)>c(OH-),根据电荷守恒判断;
C.根据图知,n(F-)=0.6a mol时,n(HF)=1.4amol,n(F-)<n(HF),溶液呈酸性,由电荷守恒知溶液中c(Na+)<c(F-);
D.pH=4时,溶液中n(HF)=0.4amol,n(F-)=1.6a mol,溶液中存在电荷守恒c(Na+)+c(H+)=c(F-)+c(OH-),则c(HF)+c(Na+)+c(H+)-c(OH-)=c(HF)-c(F-).
解答 解:A.根据图知,pH=3.45时,溶液中c(F-)=c(HF),且该溶液中存在电荷守恒c(Na+)+c(H+)=c(F-)+c(OH-),所以存在c(Na+)+c(H+)=c(HF)+c(OH-),故A正确;
B.pH=3时,溶液呈酸性,溶液中存在c(H+)>c(OH-),根据电荷守恒得:c(Na+)<c(F-),故B错误;
C.根据图知,n(F-)=0.6a mol时,n(HF)=1.4amol,n(F-)<n(HF),溶液呈酸性,由电荷守恒知溶液中c(Na+)<c(F-)<c(HF),故C错误;
D.pH=4时,溶液中n(HF)=0.4amol,n(F-)=1.6a mol,溶液中存在电荷守恒c(Na+)+c(H+)=c(F-)+c(OH-),则c(HF)+c(Na+)+c(H+)-c(OH-)=c(HF)-c(F-)=0.6mol/L,故D错误;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及计算能力,明确溶液pH与溶液中各微粒浓度关系是解本题关键,注意微粒之间的等量代换,易错选项是D,题目难度中等.


科目:高中化学 来源: 题型:推断题
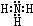 ,B的结构式为
,B的结构式为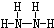 .
. .
.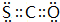 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸比磷酸易挥发 | |
| B. | 金刚石的熔点比晶体硅高 | |
| C. | 惰性气体一般很难发生化学反应 | |
| D. | 通常情况下单质溴呈液态、碘呈固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
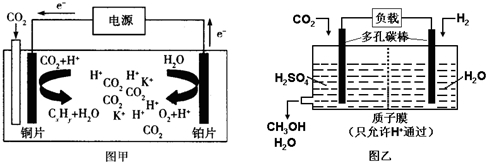
| A. | 甲中铜片作阴极,K+向铜片电极移动 | |
| B. | 甲中若CxHy为C2H4,则生成1mol C2H4的同时生成3mol O2 | |
| C. | 乙中H2SO4的作用是增强溶液的导电性 | |
| D. | 乙中正极发生的电极反应为CO2+5e-+6H+═CH3OH+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
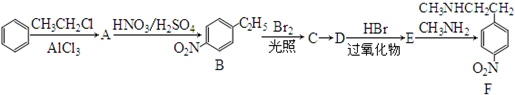
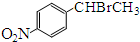 .
.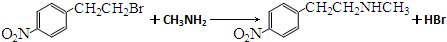 .
.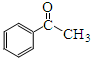 )常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线
)常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线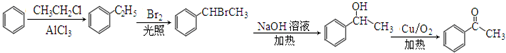 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使溴水褪色,这表现了SO2的漂白性 | |
| B. | 钠钾合金可用于快中子反应堆的热交换剂 | |
| C. | 氨的水溶液能导电,所以氨是强电解质 | |
| D. | 按a、b两种途径制备等量的硝酸镁,消耗的二种酸的物质的量不同 途径a:Mg$→_{△}^{O_{2}}$MgO$\stackrel{稀硝酸}{→}$Mg(NO3)2 途径b:Mg$\stackrel{浓硫酸}{→}$MgSO4$\stackrel{Ba(NO_{3})_{2}溶液}{→}$Mg(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
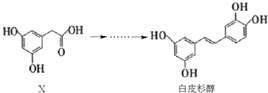
| A. | X的分子式为C8H10O4 | |
| B. | 化合物X、白皮杉醇均可与Na2CO3溶液反应并放出气体 | |
| C. | 白皮杉醇与浓溴水反应时,最多可消耗6 mol Br2 | |
| D. | 在一定条件下,白皮杉醇可发生加成、取代、氧化和聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于NA | B. | 小于NA | C. | 大于NA | D. | 等于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com