
下列离子方程式正确的是()
A. 三氯化铝溶液中加入过量氨水:Al3++3OH﹣═Al(OH)3↓
B. 向含有0.2 mol FeI2的溶液中通入0.25 mol Cl2:8I﹣+2Fe2++5Cl2═10Cl﹣+4I2+2Fe3+
C. K37ClO3与浓盐酸(HCl)在加热时生成Cl2:37ClO3﹣+6HCl═37Cl﹣+3Cl2↑+3H2O
D. 将0.1 mol/L盐酸数滴缓缓滴入0.1 mol/L 25 mL Na2CO3溶液中,并不断搅拌:2H++CO32﹣═CO2↑+H2O
考点: 离子方程式的书写.
专题: 离子反应专题.
分析: A.一水合氨为弱电解质,离子方程式或者需要保留分子式;
B.碘离子还原性大于亚铁离子,氯气不足时碘离子优先被氧化,根据亚铁离子、碘离子、氯气的物质的量判断过量情况,然后分析反应产物;
C.氧化还原反应中遵循化合价向中间靠拢原则,氯酸根离子中+5价的氯元素被还原成0价的氯气;
D.盐酸少量,反应生成碳酸氢钠,不会生成二氧化碳气体.
解答: 解:A.三氯化铝溶液中加入过量氨水,反应生成氢氧化铝沉淀和氯化铵,一水合氨不能拆开,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.0.2 mol FeI2中含有0.2mol亚铁离子、0.4mol碘离子,0.4mol碘离子消耗0.2mol氯气,剩余的0.05mol氯气能够反应0.1mol亚铁离子,说明碘离子完全反应、亚铁离子反应一半,反应的离子方程式为:8I﹣+2Fe2++5Cl2═10Cl﹣+4I2+2Fe3+,故B正确;
C.K37ClO3与浓盐酸(HCl)在加热时生成Cl2,氯酸钾中+5价Cl原子被还原为0价,正确的离子方程式为:237ClO3﹣+12HCl═2Cl﹣+37Cl2+5Cl2↑+6H2O,故C错误;
D.0.1 mol/L盐酸数滴缓缓滴入0.1 mol/L 25 mL Na2CO3溶液中,并不断搅拌,反应生成碳酸氢钠,正确的离子方程式为:H++CO32﹣═HCO3﹣,故D错误;
故选B.
点评: 本题考查了离子方程式的正误判断,为2015届高考中的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等),C为易错点,注意氧化还原反应中化合价变化规律.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
分类是化学研究中常用的方法.下列分类方法中,不正确的是()
①根据元素原子最外层电子数的多少将元素分为金属和非金属
②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质
③依据组成元素的种类,将纯净物分为单质和化合物
④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
⑥根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液.
A. 只有①③ B. ③④⑤⑥ C. ①④⑤⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种物质的转化关系.下列组合中不符合该关系的是()
A B C D
X HCl Na2O2 Na2CO3 SO2
Y FeCl2 NaOH CO2 Na2SO3
Z Cl2 Na2CO3 Ca2CO3 H2SO4
W FeCl3 NaHCO3 Ca(HCO3)2 NaHSO3
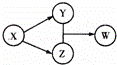
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、AlO2﹣、Al3+、CO32﹣、NO3﹣七种离子中的几种,向该溶液中逐滴加入一定量1mol/L NaOH溶液的过程中,开始没有沉淀,而后才有沉淀.则下列判断正确的是()
A. 溶液中可能含有AlO2﹣
B. 溶液中可能含有NO3﹣
C. 溶液中一定不含Fe2+和Fe3+
D. 溶液中可能含有Fe3+,但一定不含Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 滴定管装滴定液时应先用滴定液润洗
B. 在50mL量筒中配制0.1000mol•L﹣1碳酸钠溶液
C. 用pH=1的盐酸配制100mLpH=2的盐酸需要100mL容量瓶、烧杯、玻璃棒、胶头滴管
D. 欲配制1.00L1.00mol•L﹣1的NaCl溶液,可将58.5gNaCl溶于1.00L水中
查看答案和解析>>
科目:高中化学 来源: 题型:
根据物质的组成和性质将下列无机化合物进行了分类.
物质类别 酸 碱 盐 氧化物 氢化物
化学式 ①H2SO4
②HNO3 ③NaOH
④KOH ⑤Na2SO
⑥KNO3 ⑦SO2
⑧Na2O ⑨HCl
⑩NH3
(1)请仔细观察表格中的物质类别,H、O、C、N五种元素中任选两种或三种组成合适的物质,将化学式分别填在表中②、④、⑥、⑩后面的横线上.
(2)⑦和⑧可发生非氧化还原反应 一种盐.该反应的化学方程式为 .
(3)将⑦通入③的溶液中,反应的离子方程式为 .
(4)⑨极易溶于水并电离出氯离子,大多数含氯离子的盐溶于水也能电离出氯离子.检验溶液中氯离子的方法是取 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com