
分析 (1)根据关系式ClO-~2I-~I2~2S2O32-、ClO3-~6I-~3I2 ~6S2O32-计算出次氯酸钠和氯酸钠的物质的量,据此解答;
(2)氯气与氢氧化钠溶液反应生成NaCl、NaClO、NaClO3与水,结合NaClO、NaClO3的物质的量关系,配平书写方程式;
(3)计算氯气的物质的量,根据方程式计算反应后n(NaClO)、n(NaClO3)、n(NaCl),进而计算各自的浓度.
解答 解:(1)用醋酸酸化,只有次氯酸钠氧化碘化钾,消耗Na2S2O3溶液10.00mL,根据关系式:ClO-~2I-~I2~2S2O32-,则n(NaClO)=n(I2)=$\frac{1}{2}$×n(S2O32-)=$\frac{1}{2}$×0.20mol/L×0.005L=0.0005mol;
用盐酸酸化至强酸性,氯酸钾氧化碘化钠,消耗Na2S2O3溶液30.00mL;根据关系式:ClO3-~6I-~3I2 ~6S2O32-,则n(NaClO3)=$\frac{1}{6}$n(S2O32-)=$\frac{1}{6}$×0.20mol/L×0.03L=0.001mol;
故n(NaClO):n(NaClO3)=0.0005mol:0.001=1:2;
故答案为:1:2;
(2)氯气与氢氧化钠溶液反应生成NaCl、NaClO、NaClO3与水,n(NaClO):n(NaClO3)=1:2,则反应总方程式为:7Cl2+14NaOH=2NaClO3+NaClO+11NaCl+7H2O,
故答案为:7Cl2+14NaOH=2NaClO3+NaClO+11NaCl+7H2O;
(3)15.68L(标准状况)Cl2 的物质的量是:15.68 L÷22.4 L•mol-1=0.7mol,
7 Cl2+14 NaOH=2 NaClO3+NaClO+11 NaCl+7H2O
7 2 1 11
0.7mol n(NaClO3) n(NaClO) n(NaCl)
n(NaClO3)=$\frac{0.7mol×2}{7}$=0.2mol
n(NaClO)=$\frac{0.7mol×1}{7}$=0.1mol
n(NaCl)=$\frac{0.7mol×11}{7}$=1.1mol
则:c(NaClO)=$\frac{0.1mol}{0.5L}$=0.2mol/L
c(NaClO3)=$\frac{0.2mol}{0.5L}$=0.4mol/L
c(NaCl)=$\frac{1.1mol}{0.5L}$=2.2mol/L
故答案为:c(NaClO)=0.2mol/L;c(NaClO3)=0.4mol/L;(NaCl)=2.2mol/L.
点评 本题考查了有关氧化还原反应计算,明确发生反应实质,准确把握各反应物量之间的关系是解题关键,侧重考查学生分析计算能力,题目难度中等.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质生成的反应一定是氧化还原反应 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 反应前后有元素化合价变化的反应一定是氧化还原反应 | |
| D. | 金属阳离子被还原一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯丙醇胺的结构简式为: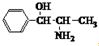 ,其分子中有2个手性碳原子 ,其分子中有2个手性碳原子 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | 完全由非金属元素形成的化合物中也可能含有离子键 | |
| D. | CO2、SiO2都是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜粉加入氯化铁溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 金属钠投到水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 氢氧化钠溶液加入到稀硫酸中:OH-+H+═H2O | |
| D. | 石灰石投入到稀盐酸中:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③⑤⑥ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别炭粉和二氧化锰 | |
| B. | 用闻气味的方法鉴别白酒和白醋 | |
| C. | 用澄清石灰水鉴别氮气和二氧化碳 | |
| D. | 用相互刻画的方法鉴别黄铜片和铜片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com