
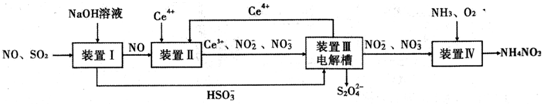
分析 装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,
装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
装置Ⅳ中通入氨气、氧气,2NO2-+O2+2H++2NH3=2NH4++2NO3-,
(1)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
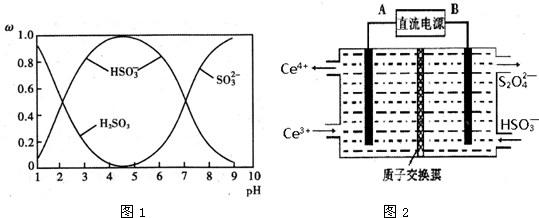
(2)①A.pH=7时,溶液为中性,结合电荷守恒分析;
B.HSO3-?SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- );
C.溶液的pH控制在4~5时,c(HSO3- )浓度最大;
D.根据质子守恒判断;
②NaOH的物质的量为1mol,根据2NaOH+SO2═Na2SO3+H2O可知二氧化硫过量,过量部分的二氧化硫再发生反应Na2SO3+H2O+SO2═2NaHSO3,依据方程式进行计算n(SO32-):n(HSO3-)的比,据此书写离子方程式;
③酸式滴定管只能盛放酸性溶液、碱式滴定管只能盛放碱性溶液;酸性高锰酸钾具有强氧化性,能氧化碱式滴定管橡皮管;原溶液无色,KMnO4为紫红色,当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色且半分钟颜色不变;
(3)生成Ce4+为氧化反应,发生在阳极上;反应物是HSO3-被还原成S2O42-,得到电子;
(4)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,设消耗标况下氧气的体积是V,结合电子守恒进行计算.
解答 解:装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,装置Ⅳ中通入氨气、氧气,2NO2-+O2++2H++2NH3=2NH4++2NO3-,
(1)装置Ⅱ中NO在酸性条件下NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
故答案为:NO+H2O+Ce4+=Ce3++NO2-+2H+;
(2)①A.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故A正确;
B.HSO3-?SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- ),由Ka的表达式可知,H2SO3的第二级电离平衡常数K2≈c(H+)=10-7,故B正确;
C.溶液的pH控制在4~5时,c(HSO3- )浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故C正确;
D.溶液存在质子守恒,应为c(OH-)=c (H+)+c(HSO3-)+2c(H2SO3),故D错误;
故答案为:ABC;
②1L1.0mol/L的NaOH溶液中含有氢氧化钠的物质的量为:1L×1.0mol/L=1.0mol,13.44L(标况下)SO2,n(SO2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,
设反应生成亚硫酸钠的物质的量为x,消耗二氧化硫的物质的量为y
2NaOH+SO2═Na2SO3+H2O
2 1 1
1.0mol y x
$\frac{2}{1.0mol}$=$\frac{1}{y}$=$\frac{1}{x}$解得:x=0.5mol y=0.5mol根据上述计算可以知道,二氧化硫是过量的,剩余的二氧化硫的物质的量为:0.6mol-0.5mol=0.1mol
所以二氧化硫会和生成的亚硫酸钠继续反应,
设消耗亚硫酸钠的物质的量为a,生成亚硫酸氢钠的物质的量为b
Na2SO3+H2O+SO2═2NaHSO3
1 1 2
a 0.1mol b
$\frac{1}{a}$=$\frac{2}{b}$=$\frac{1}{0.3mol}$解得:a=0.1mol b=0.2mol,
则溶液中n(SO32-)=0.5mol-0.1mol=0.4mol,n(HSO3-)=0.2mol,n(SO32-):n(HSO3-)=2:1,则反应的离子方程式为3SO2+5OH-=2SO32-+HSO3-+2H2O,
故答案为:3SO2+5OH-=2SO32-+HSO3-+2H2O;
③酸式滴定管只能盛放酸性溶液、碱式滴定管只能盛放碱性溶液,酸性高锰酸钾溶液呈酸性,则可以盛放在酸式滴定管中;原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,滴入最后一滴溶液呈紫红色且半分钟颜色不变;
故答案为:酸式;滴入最后一滴溶液呈紫红色且半分钟颜色不变;
(3)生成Ce4+为氧化反应,发生在阳极上,因此再生时生成的Ce4+在电解槽的阳极,连接电源正极,反应物是HSO3-被还原成S2O42-,得到电子,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:正;2HSO3-+2H++2e-=S2O42-+2H2O;
(4)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数为:1000×(5-3)×0.4mol,设消耗标况下氧气的体积是V,根据电子守恒:$\frac{VL}{22.4L/mol}$×4=1000×(5-3)×0.4mol,解得V=4480L,
故答案为:4480.
点评 本题考查电工业生产中化学原理吸收SO2和NO的工艺,为高频考点,侧重分析、计算能力的考查,题目涉及氧化还原反应、离子浓度比较、电化学等,综合性强,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L水中含有NA个水分子 | |
| B. | 常温常压下,28gCO中所含的原子数目为2NA | |
| C. | 如果11.2LN2中含有n个分子,则阿伏加德罗常数一定为2n | |
| D. | 1mo1/L的AlC13溶液中,C1-离子的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
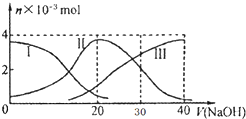 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,含A元素的有关微粒物质的量变化如图所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,含A元素的有关微粒物质的量变化如图所示.根据图示判断,下列说法正确的是( )| A. | H2A在水中的电离方程式是:H2A=H++HA-;HA-═H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)═c(A2-)+2 c(OH-) | |
| D. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:20 | B. | 1:2 | C. | 1:10 | D. | 10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)下列分子中,属于平面型构型的有CD.
(1)下列分子中,属于平面型构型的有CD.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①③④⑤⑨ | C. | ②④⑤⑦⑪ | D. | ②④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com