
分析 (1)所含元素化合价降低的反应物为氧化剂,元素化合价升高发生氧化反应得到氧化产物;
(2)学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(3)放热反应的焓变△H<0,升高温度平衡逆向移动,平衡常数减小;根据速率之比等于化学计量数之比计算v(N2);
(4)设氮气的转化率为a,表示出平衡时氮气、CO的物质的量,再根据K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$=729计算.
解答 解:(1)反应中N元素化合价降低,故N2是氧化剂,C元素元素化合价升高,发生氧化反应得到氧化产物为CO,
故答案为:N2;CO;
(2)可逆反应3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)的平衡常数表达式K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$,
故答案为:$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;
(3)对于放热反应,反应热△H<0;该反应为放热反应,升高温度平衡逆反应进行,化学平衡常数减小;
已知CO生成速率为v(CO)=18mol/(L•min),根据速率之比等于化学计量数之比,则N2消耗速率为v(N2)=$\frac{1}{3}$v(CO)=$\frac{1}{3}$×18mol/(L•min)=6mol/(L•min),
故答案为:<;减小;6mol/(L•min);
(4)设氮气的转化率为a,则反应的氮气为2a mol,则:
3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
起始量(mol):2 0
变化量(mol):2a 6a
平衡量(mol):2-2a 6a
容器体积为1L,则K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$=$\frac{(6a)^{6}}{(2-2a)^{2}}$=729,解得a=50%,
故答案为:50%.
点评 本题考查化学平衡计算、平衡常数及其应用、化学反应速率计算、氧化还原反应等,注意理解掌握平衡常数及应用,(4)计算为易错点,难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:选择题
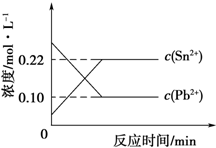 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变大 | |
| C. | 往平衡体系中加入少量金属铅后,c(Pb2+)增大 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| B. | 氟的非金属性比氯强,其最高价氧化物对应水化物的酸性比HClO4强 | |
| C. | 硒(Se)位于第四周期 VIA,其气态氢化物不如HCl稳定 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/(mg•L-1) | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
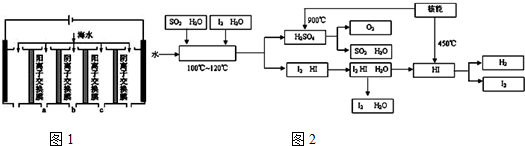
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸中放出氢气量最多 | B. | 反应速率H2SO4>HCl>CH3COOH | ||
| C. | 放出氢气量:HCl>CH3COOH | D. | 放出氢气量:HCl=CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
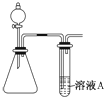 二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应I2(g)+H2(g)?2H I(g) 达平衡后,压缩体积体系颜色变深 | |
| B. | H2O2中加入二氧化锰,生成氧气的速率加快 | |
| C. | 棕黄色的FeCl3溶液中加入铁粉颜色逐渐变为浅绿色 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、HCO3-、Cl-、SO42- | B. | Na+、Fe2+、Cl-、SO42- | ||
| C. | Na+、SO42-、Cl-、ClO- | D. | NH4+、Na+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com