
分析 (1)①400℃时,N2 (g)+3H2(g)?2NH3(g)与2NH3(g)?N2 (g)+3H2(g)方程式相反,则化学平衡常数互为倒数;
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,c(N2)=c(NH3)=$\frac{2mol}{0.5L}$=4mol/L,c(H2)=$\frac{1mol}{0.5L}$=2mol/L,
根据浓度商与化学平衡常数相对大小确定反应方向,从而确定正逆反应速率相对大小;
(2)反应2NH3(g)?N2 (g)+3H2(g),正方向为体积增大的分方向,A容器能保持恒容,则反应后压强增大,B容器能保持恒压,反应后体积增大;
①根据压强大小,判断速率大小;根据压强对平衡的影响分析;
②达到平衡后,在两容器中分别通入等量的氦气,A体积不变,B体积膨胀,根据反应物浓度变化分析;
③达到平衡后,向两容器中分别通入等量的原反应气体,根据压强对平衡的影响分析;
(3)A.增大压强平衡右移;
B.压强不同,平衡状态不同;
C.升高温度平衡逆向移动;
D.催化剂不影响平衡移动.
解答 解:(1)①400℃时,N2 (g)+3H2(g)?2NH3(g)与2NH3(g)?N2 (g)+3H2(g)方程式相反,则化学平衡常数互为倒数,所以2NH3(g)?N2 (g)+3H2(g)的化学平衡常数K=$\frac{1}{0.5}$=2,
故答案为:2;
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,c(N2)=c(NH3)=$\frac{2mol}{0.5L}$=4mol/L,c(H2)=$\frac{1mol}{0.5L}$=2mol/L,
浓度商=$\frac{{4}^{2}}{4×{2}^{3}}$=0.5=K,该反应达到平衡状态,正逆反应速率相等,
故答案为:=;
(2)反应2NH3(g)?N2 (g)+3H2(g),正方向为体积增大的分方向,A容器能保持恒容,则反应后压强增大,B容器能保持恒压,反应后体积增大;
①A容器能保持恒容,则反应后压强增大,B容器能保持恒压,所以A中的压强大于B,压强越大,反应速率越快,所用时间越短,则所用时间A小于B;压强增大平衡向逆反应方向移动,所以压强越大,转化率越小,A的压强大,则A的转化率小于;
故答案为:<;<;
②达到平衡后,在两容器中分别通入等量的氦气,A体积不变,B体积膨胀,则A中各反应物质的浓度不变,A中反应速率不变,B中各反应物浓度减小,各反应物所占的压强减小,平衡正移;
故答案为:正;不变;
③达到平衡后,向两容器中分别通入等量的原反应气体,A中压强增大,新平衡原平衡相比,平衡逆向进行,则A中氢气的含量减小;
故答案为:减小;
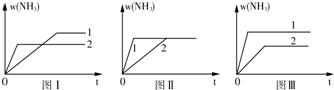
(3)A.增大压强平衡右移,氨气的含量应增大,图象与实际不符,故A错误;
B.压强不同,平衡状态不同,不可能在同一平衡状态,图象与实际不符,故B错误;
C.升高温度平衡逆向移动,氨气的含量减小,图象与实际不符,故C错误;
D.催化剂不影响平衡移动,由图象可知1到达平衡时间过短,故催化剂性能1>2,故D正确.
故答案为:D.
点评 本题考查化学平衡计算、外界条件对化学反应速率及化学平衡影响等知识点,为高频考点,侧重考查学生图象分析、判断及计算能力,注意(2)①中恒压、恒容条件下的变化量及不变量的判断,为易错点.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)c(O{H^-})}}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 时间/min/浓度mol/L | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
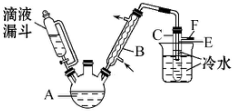 某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:
某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 148g•mol-1 | B. | 100g•mol-1 | C. | 90g•mol-1 | D. | 38g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol•L-1 | |
| B. | 饱和氯水中:c(Cl-)=c(ClO-)+c(HClO) | |
| C. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com