
| 选用试剂 | 实验现象 | |
| 方案 | ①d或b | ②溶液变成血红色或下层的四氯化碳溶液依然无色 |
分析 (2)①根据溴水的颜色来进行猜想;
②根据发生氧化还原反应生成Fe3+及Fe3+在水中的颜色来猜想;
(3)利用Fe3+的检验及萃取来进行实验的设计,Fe3+遇KSCN溶液变为红色,溴易溶于四氯化碳中,且四氯化碳与水不溶;
(4)①由氧化性Br2>Fe3+,则氯化亚铁溶液中加入1~2滴溴水发生氧化还原反应生成Fe3+;
②根据电子守恒进行计算.
解答 解:(2)①因溴水的颜色为黄色,则溶液呈黄色是因为含有Br2所致,
故答案为:Br2;
②氧化性:Br2>Fe3+,则发生2Fe2++Br2=2Fe3++2Br-,生成Fe3+且Fe3+在水中为黄色,溶液呈黄色是因为含有Fe3+所致,
故答案为:Fe3+;
(3)因Fe3+遇KSCN溶液变为红色,溴易溶于四氯化碳中,且四氯化碳与水不溶,则
| 试剂 | 实验现象 | |
| 方案1 | d | 溶液变成血红色 |
| 方案2 | b | 下层的四氯化碳溶液依然无色 |
| 试剂 | 实验现象 | |
| 方案1 | d | 溶液变成血红色 |
| 方案2 | b | 下层的四氯化碳溶液依然无色 |
点评 本题考查氧化还原反应及氧化性、还原性的比较、实验设计,学生应注意物质的性质及氧化还原反应中电子守恒来分析,题目难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.015 | B. | 0.225 | C. | 0.035 | D. | 0.045 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 ;d的晶体类型是金属.
;d的晶体类型是金属.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
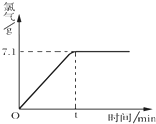 氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电.生成氯气的质量与时间的关系如图所示.请计算:
氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH.现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电.生成氯气的质量与时间的关系如图所示.请计算:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com