
(18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
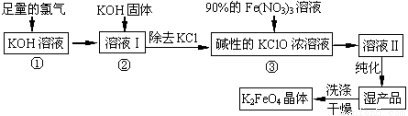
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2 反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3 、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是: FeO42? + H2O = Fe(OH)3(胶体) + O2↑ +
完成并配平上述反应的离子方程式。
(1)6KOH+3Cl2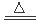 KClO3+5KCl+3 H2O (3分);3 (3分);(2)A、C (3分);
KClO3+5KCl+3 H2O (3分);3 (3分);(2)A、C (3分);
(3)2Fe3+ + 3ClO-+ 10 OH-=2FeO42- + 3Cl-+ 5H2O (3分);
(4)取最后一次的洗涤液,加硝酸银溶液,无白色沉淀则已被洗净 (3分);
(5)4FeO42- +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-(3分)。
【解析】(1)在温度较高时KOH与Cl2反应产生KCl、KClO3和水,反应的化学方程式是6KOH+3Cl2 KClO3+5KCl+3H2O;根据方程式可知:当反应中转移5 mol电子时,消耗的氯气的物质的量是3mol;(2)在反应液I中加入KOH固体的目的是与反应液I中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供碱性的环境,故选项是A、C;(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3 、KCl,根据电子守恒、电荷守恒及原子守恒可反应③中发生的离子反应方程式为2Fe3+ + 3ClO-+ 10 OH-=2FeO42- + 3Cl-+ 5H2O;(4)如果K2FeO4晶体已经洗涤干净,则表面没有杂质Cl-,因此检验K2FeO4晶体已经洗涤干净的方法是取最后一次的洗涤液,加硝酸银溶液,无白色沉淀则已被洗净;(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:4FeO42- +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-。
KClO3+5KCl+3H2O;根据方程式可知:当反应中转移5 mol电子时,消耗的氯气的物质的量是3mol;(2)在反应液I中加入KOH固体的目的是与反应液I中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供碱性的环境,故选项是A、C;(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3 、KCl,根据电子守恒、电荷守恒及原子守恒可反应③中发生的离子反应方程式为2Fe3+ + 3ClO-+ 10 OH-=2FeO42- + 3Cl-+ 5H2O;(4)如果K2FeO4晶体已经洗涤干净,则表面没有杂质Cl-,因此检验K2FeO4晶体已经洗涤干净的方法是取最后一次的洗涤液,加硝酸银溶液,无白色沉淀则已被洗净;(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:4FeO42- +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-。
考点:考查反应条件的控制、物质的作用、化学方程式和离子方程式的书写、物质洗涤干净的检验的知识。


科目:高中化学 来源:2014-2015学年黑龙江省伊春市高一上学期期中化学试卷(解析版) 题型:选择题
用NA 表示阿伏加德罗常数,64gSO2含有氧原子数为
A.1NA B.4NA C.3NA D.2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高二上学期期中化学(文)试卷(解析版) 题型:选择题
下列物质中,只含有共价键的是
A.HCl B.NaCl C.KBr D.NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面析出铜
C.把铜片插入三氯化铁溶液,在铜片表面析出铁
D.把锌放入稀盐酸中,加几滴氯化铜溶液,产生气泡速率加快
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三第一次月考化学试卷(解析版) 题型:选择题
在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高
A.所用NaOH已经潮解 B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里 D.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三上学期期中化学试卷(解析版) 题型:选择题
将12.8gMg、Al、Fe组成的合金溶于足量的NaOH溶液中,可产生0.3mol气体。另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,其质量为38.3g,则上述反应中生成NO气体的体积(标准状况下)为
A.11.2L B.33.6L C.22.4L D.6.72L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省保定市高三12月联考化学试卷(解析版) 题型:选择题
液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是

A.b极发生氧化反应
B.a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C.放电时,电流从a极经过负载流向b极
D.其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com