
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| D. | 熔点:对二甲苯>邻二甲苯>间二甲苯 |
分析 A.卤代烃密度大于水,酯的密度小于水;
B.含有氢键的物质熔沸点较高,分子晶体熔沸点与相对分子质量成正比;
C.含-OH越多,溶解性越大,卤代烃不溶于水;
D.二甲苯中,结构越对称,其熔沸点越高.
解答 解:A.卤代烃密度大于水,酯的密度小于水,所以密度四氯化碳>水>乙酸乙酯,故A错误;
B.含有氢键的物质熔沸点较高,分子晶体熔沸点与相对分子质量成正比,乙醇中含有氢键,熔沸点最高,丙烷相对分子质量大于乙烷且二者都是分子晶体,所以熔沸点:乙醇>丙烷>乙烷,故B正确;
C.含-OH越多,溶解性越大,卤代烃不溶于水,则室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷,故C正确;
D.对二甲苯>间二甲苯>邻二甲苯对称性依次减弱,依据称性越好沸点越低,沸点顺序为:对二甲苯<间二甲苯<邻二甲苯,故D正确;故选A.
点评 本题考查物质溶解度、熔沸点、密度大小比较,明确分子晶体熔沸点与溶解性的影响因素是解本题关键,注意溶解性与-OH的关系,易错选项是C.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
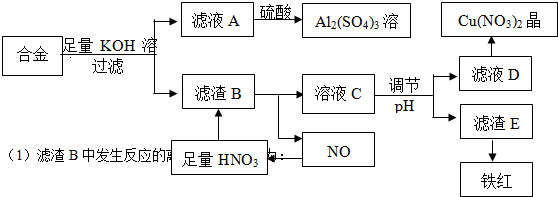
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  酚类-OH 酚类-OH | B. |  羧酸-CHO 羧酸-CHO | ||
| C. | CH3CH=CHCH=CH2 烯烃 C=C | D. | CH3-O-CH3 醚类 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 太阳能的开发和利用是21世纪的一个重要课题.
太阳能的开发和利用是21世纪的一个重要课题.| 盐 | 熔点/℃ | 熔化吸热/KJ•mol-1 | 参考价格/元•kg-1 |
| CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 36.1 | 100.1 | 1600~2000 |
| Na2S2O3•5H2O | 48.5 | 49.7 | 1400~1800 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丁炔 | B. | 丙烯 | C. | 丙炔 | D. | 2-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>D>C | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O中子数相同,质子数不同,互为同位素 | |
| B. | ${\;}_{9}^{19}$F-微粒质量数为19,电子数为9 | |
| C. | Na2O2晶体中阳离子与阴离子个数比为2:1 | |
| D. | MgCl2晶体中存在既存在离子键又存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种元素的最高正化合价中,Z的最大 | |
| B. | X、Y、Z不能形成共价化合物 | |
| C. | 原子半径:X>Y>Z | |
| D. | Y的最高价氧化物对应的水化物是强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com