
| a | b | c | d | |
| A | Cu | CuSO4 | Cu(OH)2 | Cu2O |
| B | N2 | NO2 | HNO3 | NO |
| C | CH3OH | HCHO | HCOOH | HCOOCH3 |
| D | Na | Na2O2 | NaOH | NaCl |
| A. | A | B. | B | C. | C | D. | D |
分析 依据转化关系a→b→c→d→a结合物质性质分析判断转化关系;
A、铜和浓硫酸加热反应生成硫酸铜,硫酸铜和氢氧化钠反应生成氢氧化铜,新制的氢氧化铜和乙醛在加热条件下反应生成Cu2O,Cu2O被氢气还原能一步得到铜;
B、根据物质的性质来判断,氮气与氧气一步反应只能生成NO,不能生成NO2;
C、CH3OH催化氧化得到HCHO,HCHO在进一步氧化得到HCOOH,HCOOH与CH3OH发生酯化反应生成HCOOCH3,HCOOCH3在发生水解又可生成CH3OH;
D、钠和氧气加热反应生成Na2O2,Na2O2和水反应生成NaOH,NaOH和盐酸反应生成NaCl,NaCl电解熔融可以得到钠单质;
解答 解:A、Cu$→_{△}^{浓硫酸}$CuSO4$\stackrel{NaOH}{→}$Cu(OH)2$→_{△}^{CH_{3}CHO}$Cu2O$→_{△}^{H_{2}}$Cu,可以一步实现反应,故A不选;
B、根据物质的性质来判断,N2→NO2必须经过2步氧化,即N2$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2,故B选;
C、CH3OH$\stackrel{O_{2}}{→}$HCHO$\stackrel{O_{2}}{→}$HCOOH$→_{浓硫酸加热}^{CH_{3}OH}$HCOOCH3$\stackrel{水解}{→}$CH3OH,可以一步实现反应,故C不选;
D、Na$→_{△}^{O_{2}}$Na2O2$\stackrel{H_{2}O}{→}$NaOH$\stackrel{HCl}{→}$NaCl$\stackrel{电解熔融}{→}$Na,可以一步实现反应,故D不选;
故选B.
点评 本题考查物质的转化,要熟练掌握元素及其化合物之间的转化关系,具有一定的难度,尤其是不能一步转化的反应要注意.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:填空题
| 元素组 | 例外元素 | 其他元素所属类型的编号 |
| (1)S、N、Na、Mg | N | ③ |
| (2)P、Sb、Si、As | Si | ④ |
| (3)Rb、B、Br、Fe | Fe | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
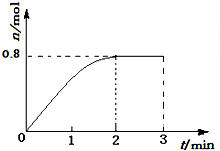 一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量如图.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 该条件下此反应的化学平衡常数的数值约为0.91 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和浓溴水用铁作催化剂制溴苯 | |
| B. | 氯乙烷与NaOH溶液共热,在水解后的溶液中直接加入AgNO3溶液检验Cl- | |
| C. | CH4与Cl2在光照条件下制备纯净的CH3Cl | |
| D. | 乙烯通入Br2的CCl4溶液中制备CH2Br-CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com