
【题目】将硫酸铜饱和溶液中加入无水硫酸铜,充分搅拌后,则( )
A.硫酸铜晶体溶解过程停止B.硫酸铜晶体结晶过程停止
C.硫酸铜晶体结晶速率等于溶解速率D.硫酸铜溶液变为不饱和溶液
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当增大压强时,下列化学反应速率不会变大的是( )
A.碘蒸气和氢气化合生成碘化氢
B.稀硫酸和氢氧化钡溶液反应
C.二氧化碳通入澄清石灰水
D.氨的催化氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
A.10℃ 20mL 3mol/L的盐酸溶液B.20℃ 10mL 4mol/L的盐酸溶液
C.20℃ 20mL 2mol/L的盐酸溶液D.20℃ 30mL 2mol/L的盐酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( ) 已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)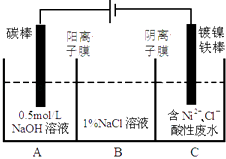
A.碳棒上发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O
B.为了提高Ni的产率,电解过程中需要控制废水pH
C.电解过程中,B中NaCl溶液的物质的量浓度将不断减小
D.若将图中阳离子膜去掉,将A,B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、X是由短周期元素组成的纯净物,其中X为单质.上述物质转化关系如图所示(某些产物略去).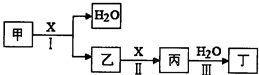
请回答下列问题:
(1)若丁是一元强酸,甲→丁是工业生产丁的主要途径.
①写出反应I的化学方程式:
②常温下,1mol丙发生反应III放出46kJ热量,该反应的热化学方程式为: .
③在常温下,向VIL pH=11的甲溶液中加入V2L pH=3的盐酸,若反应后溶液的pH<7,则V1和V2的关系为V1V2(选填“>”、“<”或“=”),所得溶液中各种离子的浓度由大到小的顺序可能是:(写一种即可).
(2)若丁是二元弱酸,丙是温室气体.
在容积为2L的容积固定的密闭容器中,将乙(g)和H2O(g)按下表用量分别进行反
应:乙(g)+H2O(g)丙(g)+H2(g),得到如下数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
乙 | H2O | 丙 | |||
1 | 650 | 4 | 2 | 1.6 | 5 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | 2 | 1 | 0.4 | 1 |
①该反应的正反应为(填“吸热”或“放热”)反应.
②900℃时,上述反应按如下起始量分别加入该容器:
物质 | 乙 | H2O | 丙 | H2 |
起始量/mol | 0.8 | 1.0 | 0.6 | 0.8 |
则此时反应的v(正) v(逆)(填“>”、“<”或“=”).
③实验3跟实验2相比,改变的条件可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。请回答:
(1)A是________,Y是________,Z是________。
(2)当X是强酸时,B是________E是________。写出B生成C的化学方程式:_________________。写出C生成D的化学方程式:__________________。
(3)当X是强碱时,B是________E是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )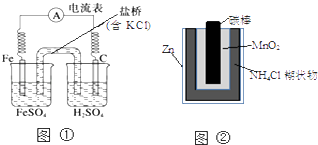
A.图①中正极附近溶液pH降低
B.图②正极反应是2MnO2(s)+H2O(l)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C.图①中电子由Fe流向石墨,盐桥中的Cl﹣移向FeSO4溶液
D.Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B能使湿润的红色石蕊试纸变为蓝色,丁为黄绿色气体,丙在丁中燃烧产生苍白色火焰,气体B与气体C相遇产生大量的白烟生成E,A是强碱,D是海水中浓度最高的盐(部分反应物和生成物已略去)。
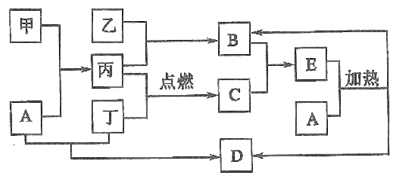
请回答下列问题:
(1)写出工业上由乙与丙生成B的化学方程式:_______________。
(2)写出甲和少量A溶液反应的离子方程式: _______________。
(3)检验E中的阳离子的方法是: _______________。
(4)B物质常见用途:_______________。(任写两条)
(5)某工厂用丁制漂白粉,写出制漂白粉的化学方程式: _______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com