
分析 (1)根据盖斯定律书写热化学方程式;
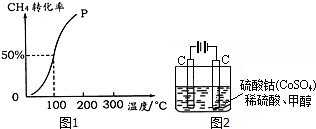
(2)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量,
①根据c=$\frac{\frac{△n}{V}}{△t}$计算v(H2);
②计算平衡状态时各物质的浓度,代入平衡常数表达式计算;
(3)其他条件不变,平衡后将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,正、逆反应速率都增大,但正反应速率增大更多,平衡向正反应方向移动,生成物的浓度增大,由于温度不变,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,据此分析解答;
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+;
③甲醇-空气-KOH溶液的燃料电池,则电池负极上是燃料失电子的氧化反应,利用电池反应方程式2CH3OH+3O2+4KOH═2K2CO3+6H20分析.
解答 解:(1)I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ•mol-1
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ•mol-1
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ•mol-1
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ•mol-1;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=$\frac{\frac{1.5mol}{100L}}{5min}$=0.003 mol•L-1•min-1,
故答案为:0.003 mol•L-1•min-1;
②100℃时反应I的平衡浓度为c(CH4)=0.050mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,
平衡常数K=$\frac{0.005×0.01{5}^{3}}{0.005×0.015}$=2.25×10-4,
故答案为:2.25×10-4;
(3)A.平衡后将容器的容积压缩到原来的$\frac{1}{2}$,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误;
B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;
C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;
D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小,故D正确;
E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误,
故答案为:CD;
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
③甲醇-空气-KOH溶液的燃料电池,则电池负极上是燃料失电子的氧化反应CH3OH-6e-+8OH-=CO32-+6H2O,甲醇-空气-KOH溶液的燃料电池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O,CH3OH与KOH的物质的量之比为1:2,1molCH3OH反应,应有2molKOH参与反应,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;2.
点评 本题考查热化学方程式书写、化学平衡图象、影响化学平衡因素、平衡常数与反应速率计算、原电池等,掌握基础是解本题的关键,题目难度中等.


 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
 硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在,硫酸盐有着许多重要的应用.
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在,硫酸盐有着许多重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:O2 (g)═O2+ (g)+e-△H1=+1175.7kJ•mol-1
(1)已知:O2 (g)═O2+ (g)+e-△H1=+1175.7kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以天然气为原料合成甲醇常见的方法有水煤气和目前正在开发的直接氧化法
以天然气为原料合成甲醇常见的方法有水煤气和目前正在开发的直接氧化法查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 石墨烯是从石墨中剥离出来的,其结构如图所示.单层的石墨烯其厚度只有一个碳原子厚,被证实是世界上已经发现的最薄、最坚硬的物质,可制成电阻率最小的纳米材料.下列关于石墨烯的说法正确的是( )
石墨烯是从石墨中剥离出来的,其结构如图所示.单层的石墨烯其厚度只有一个碳原子厚,被证实是世界上已经发现的最薄、最坚硬的物质,可制成电阻率最小的纳米材料.下列关于石墨烯的说法正确的是( )| A. | 石墨烯与金刚石互为同位素 | |
| B. | 从石墨中剥离得石墨烯需克服范德华力 | |
| C. | 石墨烯是高分子化合物 | |
| D. | 制成的纳米材料微粒直径在1nm~100nm,因此石墨烯纳米材料属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com