
【题目】已知X+Y→M+N反应中的能量变化过程如图,则下列推断一定正确的是

A. X的能量低于M的能量 B. Y的能量低于N的能量
C. X和Y总能量低于M和N总能量 D. 该反应是吸热反应,反应条件是加热
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】I.以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
①Zn为正极,Cu为负极
②H+向负极移动
③Cu极有H2产生
④电子流动方向Zn→Cu
⑤正极的电极反应式是Zn-2e-=Zn2+
⑥若有1mol电子流过导线,则理论上产生0.5 mol H2
(1)卡片中记录合理的是___________(填序号)
(2)该电池总反应的离子方程式是___________________________
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是_____________ (填“锌极”或“铜极”)
Ⅱ.某温度时,在2 L密闭容器中,三种气态物质X、 Y、Z的物质的量(n)随时间(t)变化的曲线如右图所示,可得:
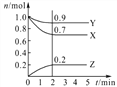
(1)该反应的化学方程式为_____________________
(2)反应开始至2 min,用Y表示的平均反应速率 为_______________
(3)在一定温度下,上述反应达到反应限度的标志的是____________
A. X、Y、Z的浓度相等
B. X、Y、Z的分子数比为3︰1︰2
C. Z的生成速率是Y的生成速率的二倍
D.单位时间内生成n mol Y,同时生成3n mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的根本原因是( )
A. 元素质量数的递增 B. 元素的原子半径呈周期性变化
C. 金属性和非金属性呈周期性变化 D. 原子核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.A~D是四种烃分子的球棍模型(如图)

(1)与A互为同系物的是___________(填序号)
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)
(3)D和液溴反应的化学方程式是___________________________
Ⅱ.某些有机物的转化如下图所示。已知:A是营养物质之一,米饭、馒头中富含A,在酸性条件下水解的最终产物是B。C是白酒的主要成分,能直接氧化成酸性物质D。
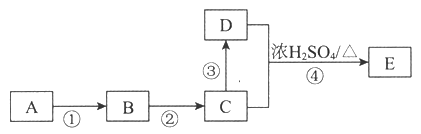
请回答下列问题:
(1)A的名称是_____________;C中官能团的名称是__________
(2)反应③所需要的试剂是__________________
(3)反应④的化学方程式是__________________________
(4)若实验室利用下图制备E,导管口不能深入N试管中液面下的原因是_______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙是一种阻锈剂,可用于染料工业,某兴趣小组拟制备Ca(NO2)2并对其性质进行探究。
【背景素材】
I.NO+NO2+Ca(OH)2=Ca(NO2)2+H2O。
Ⅱ.Ca(NO2)2能被酸性KMnO4溶液氧化成NO3-,MnO4-被还原为Mn2+。
Ⅲ.在酸性条件下,Ca(NO2)2能将I-氧化为I2,S2O32-能将I2还原为I-。
【制备氮氧化物】
(1)甲组同学拟利用如下左图所示装置制备氮氧化物。

①仪器X、Y的名称分别是______________、______________。
②装置B中逸出的NO与NO2的物质的量之比为1∶1,则装置B中发生反应的化学方程式为_____________________ ,若其他条件不变,增大硝酸的浓度,则会使逸出的气体中n(NO2)__________n(NO)(填“>”或“<”)。
【制备Ca(NO2)2】
⑵乙组同学拟利用装置B中产生的氮氧化物制备Ca(NO2)2,装置如上右图。
①装置C中导管末端接一玻璃球的作用是________________。
②装置D的作用是______________;装置E的作用是________________。
【测定Ca(NO2)2的纯度】
⑶丙组同学拟测定Ca(NO2)2的纯度(杂质不参加反应),可供选择的试剂:
a.稀硫酸 b. c1mol·L-1的KI溶液 c.淀粉溶液
d.c2mol·L-1的Na2S2O3溶液 e.c3mol·L-1 的酸性 KMnO4 溶液
①利用Ca(NO2)2的还原性来测定其纯度,可选择的试剂是______________(填字母)。
②利用Ca(NO2)2的氧化性来测定其纯度的步骤:准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,__________________(请补充完整实验步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表揭示了许多元素的相似性和递变规律,下表中所示的一些元素。

(1)写出⑥元素的离子的核外电子排布示意图____________________。
(2)给④⑤⑥⑦⑧形成的单核离子的半径从大到小排序:_________(写离子符号)。
(3)给①②③④⑤⑥⑦⑧⑨的原子半径从大到小排序:__________(写原子符号)。
(4)给②⑥⑨最高价氧化物对应水化物碱性从大到小排序__________(写化学式)。
(5)给③④⑤的非金属性从大到小排序_________(写元素符号)。
(6)③是一种用途十分广泛的非金属,请写出③的最高价氧化物与过量的⑨的氢氧化物反应的化学方程式___________________________________。
(7)⑦号元素的氢氧化物有特殊的化学性质,写出⑦号元素的氯化物与足量的⑥号元素的氢氧化物反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(v)的关系正确的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲是ⅥA族元素,其单质和化合物在化工生产等方面具有广泛应用。
(1)TeO2是两性氧化物,微溶于水,可溶于强酸、或强碱。TeO2和NaOH溶液发生反应的化学方程式为______________。
(2)碲酸(H6TeO6)是一种很弱的酸,Ka1=1×10-7,该温度下0.1mol/L H6TeO6的电离度α为_____(结果保留一位有效数字)。在酸性介质中,碲酸可将HI氧化成I2,若反应生成的TeO2与Te的物质的量之比为1:1,试配平该化学方程式。_________
______HI+_____ H6TeO6=_____TeO2+_____Te+_____I2+_____H2O
(3)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如下:

① 已知加压酸浸时控制溶液的pH为5.0,生成TeO2沉淀。如果H2SO4溶液浓度过大,将导致TeO2沉淀不完全,原因是______________。
② 防止局部酸度过大的操作方法是_____________。
③ 对滤渣“酸浸”后,将Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,该反应的离子方程式是______________。
④ “还原”得到固态碲后分离出粗碲的方法_________,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com