
| A. | 任何化学反应都可以设计成电解池反应 | |
| B. | 电解冶炼镁、铝通常电解MgCl2和Al2O3,也可电解MgO和 | |
| C. | 若把Cu+H2SO4═CuSO4+H2↑设计成电解池,应用Cu作阳极 | |
| D. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
分析 A.电解池反应必须是氧化还原反应;
B.氯化铝是共价化合物,氧化镁的熔点高;
C.Cu作阳极发生氧化反应生成铜离子;
D.铁比锡活泼,易被腐蚀.
解答 解:A.电解池反应必须是氧化还原反应,非氧化还原反应不能设计为电解池,故A错误;
B.氯化铝是共价化合物,熔融状态下不能导电,不能电解AlCl3冶炼铝,氧化镁的熔点太高,也不适用,故B错误;
C.Cu作阳极发生氧化反应生成铜离子,故C正确;
D.铁比锡活泼,易被腐蚀,当镀锡铁制品的镀层破损时,镀层锡和铁在空气中形成原电池,活泼金属铁被腐蚀,故D错误;
故选C.
点评 本题考查电化学的相关知识,学生要清楚原电池和电解池的本质都是氧化还原反应,原电池是自发进行的,注意C选项电解池为非自发进行的氧化还原反应,难度适中.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | m=4,n=2 | B. | m=4,n=5 | C. | m=3,n=3 | D. | m=5,n=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1 的KCl溶液 | B. | 0.1L 0.2mol•L-1的盐酸溶液 | ||
| C. | 0.1L 0.1 mol•L-1的MgCl2溶液 | D. | 0.1L 0.1mol•L-1的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池不能用水溶液作为电解质 | |
| B. | 阳极产生的气体为Cl2和O2 | |
| C. | 电解后该溶液的pH=2 | |
| D. | 电源正极的电极反应式为:FeS2+4e-═Fe+2S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能使溴的四氯化碳溶液褪色 | |
| B. | 葡萄糖能发生水解反应 | |
| C. | 淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
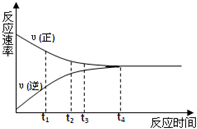 一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )| A. | t3时刻,υ(正)>υ(逆) | B. | t4时刻,υ(正)=υ(逆) | ||
| C. | t4时刻,反应达到最大限度 | D. | t4时刻,反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
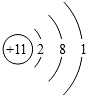 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com