
| A. | 2Fe3++Fe═3Fe2+成立说明氧化性:Fe3+>Fe2+ | |
| B. | 25℃、pH=0的溶液中,Al3+、NH4+、NO3-、Fe2+可以大量共存 | |
| C. | 5.6 g铁与足量的氯气反应失去的电子为0.2 mol | |
| D. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O |
分析 A.氧化剂的氧化性大于氧化产物的氧化性;
B.pH=0的溶液中存大大量的氢离子,H+、NO3-、Fe2+发生氧化还原反应;
C.氯气与铁反应生成氯化铁,1mol的铁转移3mol的电子;
D.电荷不守恒.
解答 解:A.2Fe3++Fe═3Fe2+反应中三价铁离子为氧化剂,二价铁离子为氧化产物,所以氧化性:Fe3+>Fe2+,故A正确;
B.pH=0的溶液中存大大量的氢离子,H+、NO3-、Fe2+发生氧化还原反应,三者不能大量共存,故B错误;
C.5.6 g铁的物质的量为0.1 mol与足量的氯气反应失去的电子为0.3 mol,故C错误;
D.硫酸亚铁溶液中加入过氧化氢溶液反应的离子方程式为:2Fe2++2H2O2+4H+=2Fe3++4H2O,故D错误;
故选:A.
点评 本题考查了元素化合物知识,明确铁及其化合物的性质是解题关键,注意C选项,氯气不足,转移电子数应依据氯气的量计算.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01 mol•(L•s)-1 | B. | v(NO)=0.008 mol•(L•s)-1 | ||
| C. | v(H2O)=0.003 mol•(L•s)-1 | D. | v(NH3)=0.003 mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出的热量为(0.4Q1+0.1Q3)KJ | B. | 放出的热量为(0.4Q1+0.05Q2)KJ | ||
| C. | 放出的热量为(0.4Q1+0.05Q3)KJ | D. | △H2<△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ⑬ | |||||||
| 2 | ① | ⑭ | ② | |||||
| 3 | ③ | ④ | ⑥ | ⑤ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
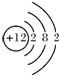 ,⑥
,⑥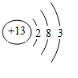 ,⑧
,⑧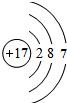 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com