
分析 (1)根据m(溶质)=m(溶液)×ω计算溶质的质量,计算混合后溶液的质量,利用混合后溶质的质量等于原不同浓度溶液中氯化钠的质量之和计算混合后溶质氢氧化质量分数;
(2)根据c=$\frac{1000ρω}{M}$计算混合液的物质的量浓度.
解答 解:(1)将20.0g 14%的NaCl溶液跟30.0g 24%的NaCl溶液混合,混合后溶液的质量为:20g+30g=50g,
设混合后NaCl的质量分数为ω,则:50g×ω=20g×14%+30g×24%,解得:ω=20%,
答:混合后NaCl溶液的质量分数为20%;
(2)混合后溶液中NaCl的物质的量浓度为:$\frac{1000×1.15×20%}{58.5}$mol/L=3.93mol/L,
答:混合后氯化钠溶液的物质的量浓度为3.93mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度、溶质质量分数的概念及表达式即可解答,注意掌握物质的量与溶质质量分数的关系,试题培养了学生的化学计算能力.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:填空题
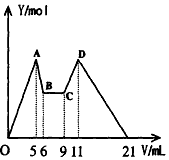
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、Cl-、OH- | B. | Cl-、OH-、CO32- | C. | OH-、Cl-、CO32- | D. | CO32-、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -(6a-12b-4c+5d)kJ•mol-1 | B. | -(-6a+12b+4c-5d)kJ•mol-1 | ||
| C. | -(-4a+6b+4c-5d)kJ•mol-1 | D. | -(4a-6b-4c+5d)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三个反应均为放热反应,故不需要加热就能进行 | |
| B. | CO(g)+2H2(g)═CH3OH(g);△H>-90.5 kJ/mol | |
| C. | 甲醇的燃烧热为764 kJ/mol | |
| D. | 若CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A. | 碱 | 酸 | 石蕊 | 乙 |
| B. | 酸 | 碱 | 酚酞 | 甲 |
| C. | 碱 | 酸 | 甲基橙 | 乙 |
| D. | 酸 | 碱 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ②③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com