
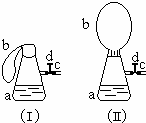
 如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:分析 (1)不考虑浮力,则反应前后装置遵循质量守恒;
(2)氢氧化钙的溶解度较小,生成的沉淀为氢氧化钙,摇动后氢氧化钙与盐酸反应导致沉淀消失;
(3)先根据题干数据计算出HCl、NaOH的物质的量,然后判断过量情况;最后中和反应为放热反应判断温度变化;
(4)继续轻摇瓶a,二氧化碳会与氢氧化钙、氢氧化钠发生反应.
解答 解:(1)反应前后装置中的反应遵循质量守恒,即:W1=W2,
故答案为:相等;
(2)溶液中含有氯化钙,氢氧化钙溶解度较小,则加入氢氧化钠溶液后钙离子与氢氧化钠结合生成氢氧化钙沉淀,轻摇后沉淀又与盐酸反应而消失,发生的反应方程式为:Ca(OH)2+2HCl=CaCl2+2H2O,
故答案为:Ca(OH)2+2HCl=CaCl2+2H2O;
(3)43.8g10%的稀盐酸中含有HCl的物质的量为:$\frac{43.6g×10%}{36.5g/mol}$≈0.12mol,30g质量分数为20%的NaOH溶液中含有氢氧化钠的物质的量为:$\frac{30g×20%}{40g/mol}$=0.15mol,则混合液中氢氧化钠过量,瓶内不再溶解,产生大量氢氧化钙沉淀,由于中和反应为放热反应,则瓶内温度升高,
故答案为:升高;
(4)产生的二氧化碳会和过量的碱反应,使气压减小,气球变小,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O、CO2+Ca(OH)2═CaCO3↓+H2O,
故答案为:2NaOH+CO2═Na2CO3+H2O、CO2+Ca(OH)2═CaCO3↓+H2O.
点评 本题考查了实验装置的综合应用,题目难度中等,明确实验目的、实验原理为解答关键,注意掌握常见元素及化合物性质,试题侧重考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7克-OH中含有的电子数为NA | |
| B. | 42g乙烯与丙烯的混合气体中含碳原子数为3NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA | |
| D. | 乙烯和乙醇的混合物共0.1mol,完全燃烧所消耗的氧气的分子数一定为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+,无K+ | |
| B. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| C. | 进行钠的焰色反应实验,可用到的实验用品有:铂丝、氯化钠溶液、稀盐酸 | |
| D. | 焰色反应是某些金属单质具有的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图是常温下等物质的量浓度的部分短周期元素最高价氧化物对应水化物的稀溶液的pH与原子序数的关系图,Z的氧化物是两性氧化物.下列说法正确的是( )
如图是常温下等物质的量浓度的部分短周期元素最高价氧化物对应水化物的稀溶液的pH与原子序数的关系图,Z的氧化物是两性氧化物.下列说法正确的是( )| A. | E、X、L三种元素的非金属性强弱关系为E<L<X | |
| B. | 同浓度的W、R两种元素的最高价氧化物对应水化物的溶液中,pH后者更小 | |
| C. | 元素Z、J对应的单质均能与Y的最高价氧化物对应的水化物反应生成H2,故它们的性质相同 | |
| D. | 元素X、Y、W形成的某化合物的溶液能与W的最高价氧化物对应的水化物反应生成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
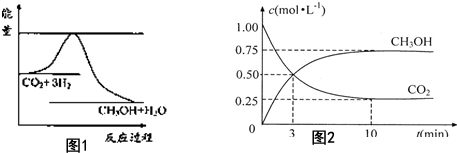 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
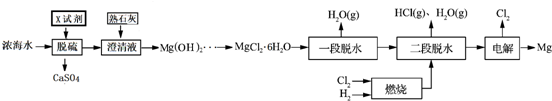
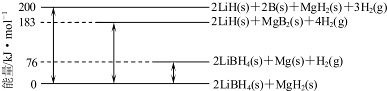
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com