
A、NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-
| ||||
| B、向NH4Al(SO4)2溶液中滴人Ba(OH)2溶液使SO42-反应完全:2Ba2++3OH-十Al3++2SO42-═2BaSO4↓+Al(OH)3↓ | ||||
| C、向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
| D、硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| ||


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
| A、SO42-的摩尔质量是96g |
| B、常温压下,14g CO和N2的混合气体的分子数是0.5NA |
| C、标准状况下,22.4L CCl4中含有的CCl4分子数位NA |
| D、1mol O2参加反应转移电子数一定为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.25 mol/(L?s) |
| B、0.75 mol/(L?s) |
| C、0.83 mol/(L?s) |
| D、0.5 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的产量是衡量一个国家石油发展水平的标志 |
| B、减少燃煤的使用可以减少有毒有害气体对环境的污染 |
| C、将废弃塑料制品用化学方法加工成防水涂料或汽油 |
| D、35%--60%甲醛溶液俗称为福尔马林,具有很好的防腐杀菌效果,可用来浸泡海产品来起到保鲜效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定条件下,催化分解80g SO3,混合气体中含有的氧原子数为3NA |
| B、一定条件下,铁与水蒸气反应生成8.96L(已折合成标准状况)H2时,转移的电子数为0.8NA |
| C、各取1mol/L AlCl3与3mol/L NaCl溶液100mL混合后,溶液中所含Cl-数为0.6NA |
| D、含有非极性键的数目为NA的Na2O2与水充分反应,标准状况下产生22.4L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | 盐酸 | 胆矾 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
| C | 苛性钠 | 醋酸 | 石灰石 | 水 |
| D | 苛性钠 | 碳酸 | 碳酸镁 | 三氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
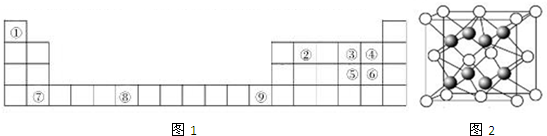
| IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ③ | ④ | ||||||
| 3 | ② | ⑤ | ⑥ | |||||
| 4 | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com