
A、B、C、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素。
已知:
A原子的核外电子数与电子层数相等;
B元素原子的核外p电子数比s电子数少1个;
C原子的第一至第四电离能为I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol;
D原子核外所有p轨道为全充满或半充满;
E元素的族序数与周期序数的差为4;
(1)写出E元素在周期表位置:________;D元素的原子的核外电子排布式:____________________。
(2)某同学根据题目信息和掌握的知识分析C的核外电子排布为
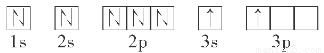
该同学所画的轨道式违背了________。

(3)已知BA5为离子化合物,写出其电子式:______________。
(4)DE3中心原子杂化方式为__________________,其空间构型为______________。
(5)某金属晶体中原子堆积方式如图甲,晶胞特征如图乙,原子相对位置关系如图丙,则晶胞中该原子配位数为________;空间利用率为________;该晶体的密度为________。(已知该金属相对原子质量为m,原子半径为a cm)
(1)第三周期ⅦA族 1s22s22p63s23p3
(2)能量最低原理
(3) 
(4)sp3 三角锥形
(5)12 74%  g/cm3
g/cm3
【解析】(1)由题意分析知F为K;A为H;B为N;由电离能知C的+2价稳定,为Mg;D为P;E为Cl。(2)原子的核外电子分能级排布,按构造原理先排能量低的能级,再排能量高的能级,遵循能量最低原理时,该原子才最稳定。该同学未排满3s能级,就排3p能级,违背了能量最低原理。(3)NH5为离子化合物,则为铵盐,存在NH4+和H-。(4)PCl3中心原子P上的价层电子对=3+ (5-3×1)=4,杂化类型为sp3杂化;存在一个孤电子对,故分子构型为三角锥形。(5)由图可知:该金属堆积方式为面心立方最密堆积,原子配位数为12,空间利用率为74%;由图乙可知每个晶胞中含有的原子数为8×
(5-3×1)=4,杂化类型为sp3杂化;存在一个孤电子对,故分子构型为三角锥形。(5)由图可知:该金属堆积方式为面心立方最密堆积,原子配位数为12,空间利用率为74%;由图乙可知每个晶胞中含有的原子数为8× +6×
+6× =4。设晶胞的棱长为x,由图丙知x2+x2=(4a)2,x=2
=4。设晶胞的棱长为x,由图丙知x2+x2=(4a)2,x=2 a,若该晶体的密度为ρ,则
a,若该晶体的密度为ρ,则 。
。
点拨:本题考查物质结构与性质,考查考生对物质结构与性质的掌握情况。难度较大。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题14实验化学(选修)练习卷(解析版) 题型:选择题
下列说法不正确的是( )。
A.利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体再从上面倒出
B.用玻璃棒蘸取新制氯水,滴在pH 试纸上,然后与比色卡对照,可测定新制氯水的pH
C.在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、环形玻璃搅拌棒进行搅拌、酸和碱正好反应、取2~3 次的实验平均值,以达到良好的实验效果
D.固体药品取用:块状固体用镊子夹取,粉末状的用药匙或纸槽转移
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 离子反应、氧化还原反应练习卷(解析版) 题型:选择题
下列解释事实的方程式不正确的是( )
A.用浓盐酸检验氨:NH3+HCl=NH4Cl
B.碳酸钠溶液显碱性:CO32—+H2O HCO3—+OH-
HCO3—+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 电化学原理及其应用练习卷(解析版) 题型:填空题
过氧化银(Ag2O2)是银锌碱性电池正极的活性物质,可通过下列反应制备:
K2S2O8+2AgNO3+4KOH Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
(1)已知K2S2O8和H2O2含有一个相同的化学键,则该反应________ (填“是”或“不是”)氧化还原反应;已知下列反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+(未配平),反应中氧化剂与还原剂的物质的量之比为________。
(2)制备Ag2O2的反应进行完全后,经过滤、洗涤、干燥,即可得到Ag2O2,检验Ag2O2是否洗涤干净的方法是________。
(3)一种银锌(Ag2O2、Zn)碱性电池的电解质溶液为KOH溶液,电池放电时正极生成Ag,负极只生成一种化合物(只含有Zn、K、H、O),其中Zn元素的质量分数为30%,钾、锌两种元素的质量比为78?65,则该电池的总反应方程式为________。
(4)用银锌电池电解尿素[CO(NH2)2]的碱性溶液可制取H2,其装置如图所示(电解池中隔膜仅阻止气体通过,M、N均为惰性电极)。

①N极与银锌电池的________(填“Zn”或“Ag2O2”)相连。
②M极的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 电化学原理及其应用练习卷(解析版) 题型:选择题
电化学在日常生活中用途广泛,图甲是镁—次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是( )

A.图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去
B.图乙的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生
C.图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D.若图甲中3.6 g镁溶液产生的电量用以图乙废水处理,理论可产生10.7 g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质结构与性质练习卷(解析版) 题型:选择题
NH3、H2O等是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。根据上述事实可推ABn型分子是非极性分子的经验规律是( )
A.在ABn分子中A原子的所有价电子都参与成键
B.在ABn分子中A的相对原子质量应小于B的相对原子质量
C.在ABn分子中每个共价键的键长都相等
D.分子中不能含有氢原子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质结构与性质练习卷(解析版) 题型:选择题
我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2 CO2+H2O。下列有关说法正确的是( )
CO2+H2O。下列有关说法正确的是( )
A.该反应为吸热反应
B.CO2分子中的化学键为非极性键
C.HCHO分子中既含σ键又含π键
D.每生成1.8 g H2O消耗2.24 L O2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质的量及其应用练习卷(解析版) 题型:实验题
甲同学欲配制100 mL 3.6 mol/L的稀硫酸。
(1)若采用18 mol/L的浓硫酸配制该溶液,需要浓硫酸的体积为________mL;所选用容量瓶的规格为________mL。
(2)甲同学的配制步骤:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶中加水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①洗涤操作中,将洗涤烧杯后的溶液也注入容量瓶,其目的是________。
②定容的正确操作是继续加蒸馏水至离刻度线下________时,改用________加水至液面与刻度线相切。
③用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填字母序号,下同)。
A.吸出多余液体,使凹液面与刻度线相切
B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切
C.经计算加入一定量的浓硫酸
D.重新配制
(3)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出
B.定容时俯视读取刻度
C.容量瓶用蒸馏水洗净后未干燥
D.定容时液面超过了刻度线
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 常见无机物及其应用练习卷(解析版) 题型:实验题
某化学兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠。设计装置如下(忽略装置中空气的影响),请回答下列问题:

(1)组装好仪器后,必须进行的一项操作是_________________。
(2)装置A的试管中发生反应的化学方程式是_______________。
(3)推测B中可以观察到的主要现象是________;C装置的作用是________。
(4)装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是________;可以通过适当改进,不产生Y物质,请你提出改进方法:______________________。
(5)已知:亚硝酸是弱酸,不稳定,室温下存在反应3HNO2=HNO3+2NO↑+H2O;在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
①写出检验D中产物是亚硝酸钠的方法:_________________;
②E装置中试剂X可以是________。
A.稀硫酸 B.酸性高锰酸钾溶液
C.稀硝酸 D.水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com