
| A | B | C | D | E |
| A. | HnDOm为强酸时,E的非金属性一定很强 | |
| B. | A(OH)n为强碱时,B(OH)m也一定为强碱 | |
| C. | E元素的最高化合价为+7时,D元素的负化合价可为-2价 | |
| D. | HnCOm为强酸时,E的单质可能有强还原性 |
分析 同一周期元素,元素的非金属性随着原子序数增大而增强、元素的金属性随着原子序数增大而减弱,
A.HnDOm为强酸时,E可能为稀有气体元素;
B.根据同周期元素的金属性的递变规律分析;
C.E元素的最高化合价为+7时,为ⅦA族元素,则D为ⅥA族元素;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,其单质的氧化性越强.
解答 解:A.A、B、C、D、E五种元素同周期,E(除了稀有气体元素)的非金属性比C强,HnCOm为强酸时,E如果是稀有气体,则没有强还原性,故A错误;
B.A、B为短周期元素,A的金属性大于B,如果A(OH)n为强碱时,B(OH)m不是强碱,故B错误;
C..E元素的最高化合价为+7时,为ⅦA族元素,则D为ⅥA族元素,则D元素的负化合价可为-2价,故C正确;
D.HnCOm为强酸时,C的非金属性较强,非金属性E>D>C,元素的非金属性越强,其单质的氧化性越强,所以E的单质不可能有强还原性,故D错误.
故选C.
点评 本题考查了元素周期律,为高频考点,侧重考查学生的分析能力,明确同一周期元素金属性、非金属性强弱变化规律是解本题关键,再结合元素非金属性强弱与其最高价氧化物的水化物酸性强弱之间的关系分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 候氏制碱、制取肥皂的工艺过程中均应用了物质溶解度的差异 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦提取青蒿素的过程中发生了化学变化 | |
| C. | “外观如雪,强烧之,紫青烟起”,南北朝陶弘景对硝酸钾的鉴定过程中利用了焰色反应 | |
| D. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
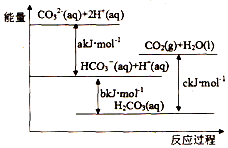
| A. | H2CO3(aq)=CO2(g)+H2O(l)为放热反应 | |
| B. | CO32-(aq)+H+(aq)=HCO3-(aq)△H=akJ/mol | |
| C. | HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)△H=(c-b)kJ/mol | |
| D. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(a+b-c)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有红棕色出现 | |
| B. | 滴入 AgNO3溶液,再加入稀 HNO3,观察有无浅黄色沉淀生成 | |
| C. | 加入 NaOH 溶液共热,然后加入稀 HNO3使溶液呈酸性,再滴入 AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入 NaOH 溶液共热,冷却后加入 AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
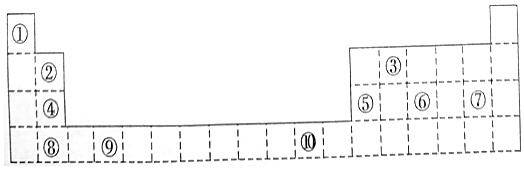
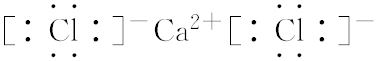 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子反应 | B. | 吸热反应 | C. | 复分解反应 | D. | 氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据元素在周期表中的位置,推测元素的原子结构 | |
| B. | 指导新元素的发现和合成,预测新元素的性质 | |
| C. | 在金属与非金属的分界线附近寻找半导体材料 | |
| D. | 在零族元素中寻找耐腐蚀的金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2(c1<c2),则时间间隔为 t1~t2内(t1<t2,以秒为单位),SO3(g)生成的平均速率为v=$\frac{({c}_{2}-{c}_{1})}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com