
某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。
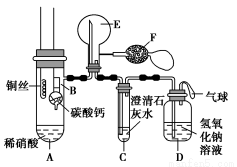
实验操作及现象:
实验操作 | 现象 |
Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
Ⅱ.当C装置中产生白色沉淀时,立刻将B装置上提 |
|
Ⅲ.将A装置中铜丝放入稀硝酸中,给A装置微微加热 | A装置中产生无色气体 E装置中开始时出现浅红棕色气体 |
Ⅳ.用F装置向E装置中鼓入空气 | E装置内气体颜色逐渐加深 |
Ⅴ.一段时间后 | C装置中白色沉淀溶解 |
试回答下列问题:
(1)操作Ⅰ中产生气体的化学式为 ;操作Ⅰ的目的是 ;D装置的作用是 。
(2)C装置中白色沉淀的化学式是 ,操作Ⅱ中当C装置中产生白色沉淀时立刻将B装置上提的原因是 。
(3)操作Ⅲ中A装置中产生无色气体的化学方程式是 。
(4)E装置内气体颜色逐渐加深的原因是 。
(5)操作Ⅴ现象产生的原因是(用化学方程式说明) 。
(1)CO2 用碳酸钙与稀硝酸反应产生的二氧化碳赶走装置内的空气 平衡压强,吸收NO、NO2、CO2尾气,防止污染大气
(2)CaCO3 防止消耗稀硝酸过多,从而影响铜与稀硝酸的反应
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(4)CO2的密度比空气的大,CO2从长管进入E装置,并没有把E装置中的空气排尽,致使部分NO先与未排尽的空气反应生成少量红棕色NO2,当用F装置鼓入空气时,E装置中有更多NO2生成,所以红棕色加深
(5)3NO2+H2O=2HNO3+NO(或4NO+3O2+2H2O=4HNO3),CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O
【解析】该实验的原理是首先用碳酸钙与稀硝酸反应产生的CO2将装置中的空气排尽,以防止空气中的氧气对实验造成干扰,然后铜与稀硝酸反应产生气体,通过向E装置中通入空气,气体颜色变深,说明铜与稀硝酸反应产生的气体为NO,最后处理尾气。(1)操作Ⅰ是用碳酸钙与稀硝酸反应产生的CO2将装置中的空气排尽,以防止空气中的氧气对实验干扰。(2)C装置中白色沉淀是CaCO3,操作Ⅱ中当C装置中产生白色沉淀时立刻将B装置上提是防止消耗稀硝酸过多,从而影响铜与稀硝酸的反应。(3)操作Ⅲ中A装置中发生的是铜与稀硝酸的反应。(4)E装置内气体颜色逐渐加深是由于E装置中有更多NO2生成。(5)操作Ⅴ现象产生的原因是NO2与H2O反应生成硝酸,硝酸与CaCO3反应。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源:2014年高考化学题型冲刺练习 基础实验题(解析版) 题型:选择题
下列对实验现象的解释与结论,正确的是( )
选项 | 实验操作 | 实验现象 | 解释与结论 |
A | 向鸡蛋清溶液中加入 饱和(NH4)2SO4溶液 | 有白色沉淀产生 | 蛋白质变性 |
B | 向某溶液中加入盐酸 酸化的BaCl2溶液 | 有白色沉淀产生 | 该溶液中一定含有SO |
C | 向甲苯中滴入少量浓 溴水,振荡,静置 | 溶液分层,上层呈橙红 色,下层几乎无色 | 甲苯和溴水发生取代反 应,使溴水褪色 |
D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀, 放出刺激性气体 | 浓硫酸具有脱水性和强 氧化性,反应中生成C、 SO2和CO2等 |
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版专练3限定条件离子共存及离子方程式书写练习卷(解析版) 题型:选择题
某溶液中存在XO-,且X为短周期元素,则一定能在该溶液中大量共存的离子组是( )。
A.Na+、H+、SO42-、I- B.Na+、Ca2+、CO32-、Al3+
C.Na+、K+、Fe2+、H+ D.K+、SO42-、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是( )。
A.3 mol NF3与水完全反应生成HNO3和NO,转移电子数2 NA
B.标准状况下,32 g硫(结构见图)含SS的数目为2 NA
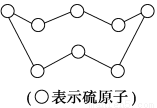
C.标准状况下11.2 L正戊烷所含共用电子对数为8NA
D.含a mol·L-1 H+的醋酸溶液稀释10倍后,H+为0.1aNA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
NA代表阿伏加德罗常数。下列叙述正确的是( )。
A.标准状况下,22.4 L己烷中C—C共价键数目为5NA
B.0.1 mol·L-1 AlCl3溶液中含有氯离子数为0.3NA
C.1 mol Fe在1 mol Cl2中充分燃烧,转移电子数为3NA
D.20 g重水(12H2O)所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练1 化学实验仪器的创新使用练习卷(解析版) 题型:选择题
下列有关实验原理或实验操作的叙述正确的是 ( )。
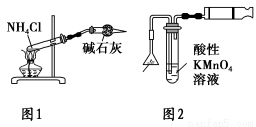
A.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘上称量
B.欲除去NO中少量的NO2,将混合气体通入足量NaOH溶液
C.实验室用图1所示装置制取少量氨气
D.实验室用图2所示装置检验火柴头燃烧产生的SO2
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:填空题
某温度(t℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
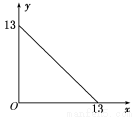
(1)此温度下,水的离子积KW为________,则该温度t__________25℃(填“>”“<”或“=”),pH=7的溶液显________(填“酸”“碱”或“中”)性。
(2)若将此温度(t℃)下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计)。试通过计算填写以下不同情况时两种溶液的体积比。
①若所得混合液为中性,则a∶b=______________________________________;
②若所得混合液的pH=2,则a∶b=____________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:填空题
(1)合成氨反应的热化学方程式:N2(g)+3H2(g) 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少在反应混合物中要投放N2的物质的量为________ mol。
(2)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式:__________________________,
负极的电极反应式:__________________________。
(3)如图是一个电解过程示意图。
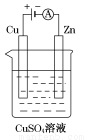
①锌片上发生的电极反应式是:_______________________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol F-F:153 kJ/mol H-F:565 kJ/mol,下列说法正确的是( )
A.H2与F2反应的热化学方程式为:
H2(g)+F2(g)=2HF(g) ΔH=-541 kJ
B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量
C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ
D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com