
下列说法不正确的是
A.稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度
B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液pH约为12
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
【答案】C
【解析】
试题分析:A.醋酸在溶液中存在电离平衡:CH3COOH CH3COO-+H+,当想稀醋酸中加入少量醋酸钠固体时,溶液中c(CH3COO-)增大,醋酸的电离平衡逆向移动,从而减小了醋酸的电离程度,正确;B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液中c(OH-)=(0.02 mol·L-1×2-0.02 mol·L-1)÷2=0.01mol/L,由于在室温下水的离子积常数是10-14,所以c(H+)=10-12mol/L,故溶液pH约为12,正确;C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,第一种溶液中氢离子的浓度是第二种溶液中氢离子浓度的10倍。由于溶液的浓度越大,其电离程度就越小,所以则c1>10c2,错误;D.pH=11的NaOH溶液的氢氧根离子的浓度与pH=3的醋酸溶液中氢离子的浓度相等。由于醋酸是弱酸,主要以电解质分子存在,在溶液中存在电离平衡,党二者等体积混合后,由于醋酸过量,溶液显酸性,滴入石蕊溶液时,溶液呈红色,正确。
CH3COO-+H+,当想稀醋酸中加入少量醋酸钠固体时,溶液中c(CH3COO-)增大,醋酸的电离平衡逆向移动,从而减小了醋酸的电离程度,正确;B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液中c(OH-)=(0.02 mol·L-1×2-0.02 mol·L-1)÷2=0.01mol/L,由于在室温下水的离子积常数是10-14,所以c(H+)=10-12mol/L,故溶液pH约为12,正确;C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,第一种溶液中氢离子的浓度是第二种溶液中氢离子浓度的10倍。由于溶液的浓度越大,其电离程度就越小,所以则c1>10c2,错误;D.pH=11的NaOH溶液的氢氧根离子的浓度与pH=3的醋酸溶液中氢离子的浓度相等。由于醋酸是弱酸,主要以电解质分子存在,在溶液中存在电离平衡,党二者等体积混合后,由于醋酸过量,溶液显酸性,滴入石蕊溶液时,溶液呈红色,正确。
考点:考查电解质溶液的有关知识。
【题型】选择题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(s) zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
A.C的体积分数降低
B.x+y=z
C.平衡向正反应方向移动
D.x+y<z
科目:高中化学 来源:2015-2016学年江西省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知链式炔碳C300经过适当处理可得含多个—C≡C—(不含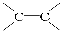 )的链状化合物C300H298,则该分子中含—C≡C—的个数为( )
)的链状化合物C300H298,则该分子中含—C≡C—的个数为( )
A.70 B.72 C.74 D.76
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省怀化市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列措施不利于改善湖南地区环境质量的是
A.回收废电池
B.使用太阳能热水器
C.使用不易降解的塑料餐具
D.推广使用清洁燃料的公交车
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
下列变化过程中,只破坏共价键的是
A.I2 升华
B.NaCl颗粒被粉碎
C.HCl溶于水得盐酸
D.从NH4HCO3中闻到了刺激性气味
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:填空题
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气的主要成分之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_____________________________(填元素符号)。
(3)元素的非金属性Z____Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有 (填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊 |
B.Z与Q之间形成的化合物中元素的化合价 |
C.Z和Q的单质的状态 |
D.Z和Q在周期表中的位置 |
(4)X与Y可形成简单分子A,写出A的电子式_______________;实验室制备气体A的化学方程式 。
【答案】(1)第三周期第VIA族 (2)Na>S>N>O>H
(3)> ;C;(4) 2NH4Cl+Ca(OH)2
2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
【解析】试题分析:X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,则Z为O元素;J元素的焰色反应呈黄色,则J为Na;Q的最外层电子数与其电子总数比为3:8,原子序数大于Na元素,故Z处于第三周期,则Q为S元素;X能与J形成离子化合物,且J+的半径大于X-的半径,可推知X为H元素;Y的氧化物是形成酸雨的主要物质之一,结合(5)中X与Y可形成分子,也可形成阳离子,则Y为N元素。(1)Q为S元素,原子核外有3个电子层、最外层电子数为6,处于周期表中第三周期ⅥA族;(2)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Na>S>N>O>H;(3)O、S同主族自上而下非金属性减弱,故非金属性O>S;a.H2S的水溶液放置在空气中会变浑浊,说明氧气能氧化硫化氢生成硫,则氧气的氧化性大于S,说明O元素非金属较强,正确;b.S与O元素形成的化合物中S元素表现正化合价,O元素表现负化合价,氧原子对键合电子吸引力更大,氧元素非极性较强,正确;c.单质状态属于物理性质,不能比较非金属性强弱,错误;d.同主族自上而下非金属性减弱,故非金属性O>S,正确,(4)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,A为NH3,电子式为 ,在实验室是用NH4Cl和Ca(OH)2混合加热制取氨气,反应的化学方程式是:2NH4Cl+Ca(OH)2
,在实验室是用NH4Cl和Ca(OH)2混合加热制取氨气,反应的化学方程式是:2NH4Cl+Ca(OH)2 CaCl2+2H2O+2NH3↑。
CaCl2+2H2O+2NH3↑。
考点:考查元素化合物推断、物质结构与性质机元素在周期表的位置关系应用的知识。
【题型】推断题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)830℃,在1L的固定容器的密闭容器中放入1 mol CO和5 mol H2O,反应达平衡后,其化学平衡常数K 1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡。在其他条件不变的情况下,扩大容器的体积,平衡 移动。(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为 (选填“正反应方向”、“逆反应方向”、“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
下列装置或操作能达到实验目的的是
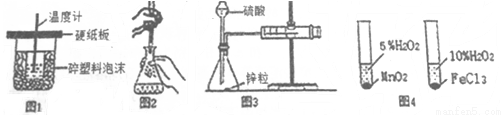
A.图1装置用于中和热的测定
B.图2装置用于高锰酸钾溶液滴定草酸
C.图3装置用于测定氢气的反应速率(单位mL/s)
D.图4装置用于研究不同催化剂对反应速率的影响
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
下列各粒子:①H3O+、NH4+、Na+;②OH-、NH2-、F-;③O2-、Na+、Mg2+;④CH4、NH3、H2O具有相同质子数和电子数的一组是
A. ①②③ B. ①②④ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是
A | B | C | D | |
被提纯物质 | 酒精(水) | 乙醇(乙酸) | 乙烷(乙烯) | 溴苯(溴) |
除杂试剂 | 生石灰 | 氢氧化钠溶液 | 酸性高锰酸钾溶液 | KI溶液 |
分离方法 | 蒸馏 | 分液 | 洗气 | 分液 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南琼海嘉积中学高一下期末文科化学试卷(解析版) 题型:选择题
下列关于化学平衡的说法中,正确的是( )
A.当达到化学平衡时,各物质的浓度就不再变化了
B.当达到化学平衡时,反应物已完全转化为生成物
C.当达到化学平衡时,反应混合物中各成分的浓度相等
D.当达到化学平衡时.正逆反应均已停止
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com