
(6分)将一定量的NaHCO3和Na2CO3的混合物放在密闭的容器中加热,充分反应后,测得容器中CO2的体积为1.12L(标准状况)。将反应后的固体与200mL某浓度的盐酸恰好完全反应,转化为4.48LCO2。试回答:
(1)盐酸的物质的量浓度为 。
(2)求原混合物中NaHCO3与Na2CO3的质量比 。
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
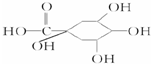
 (2012?长春三模)[化学-选修 有机化学基础]注射用双黄链以绿原酸为主要成分(其结构如图)绿原酸有广泛的药理作用.
(2012?长春三模)[化学-选修 有机化学基础]注射用双黄链以绿原酸为主要成分(其结构如图)绿原酸有广泛的药理作用.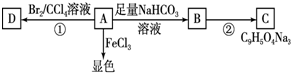


| a |
| 112 |
| b |
| 90 |
| a |
| 112 |
| b |
| 90 |
查看答案和解析>>
科目:高中化学 来源:2013届浙江省金华一中高三12月月考化学试卷(带解析) 题型:计算题
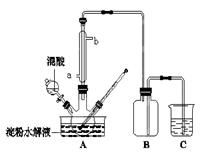
(15分)淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;②将一定量的淀粉水解液加入三颈烧瓶中;③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3、98%H2SO4的质量比为2:1.5)溶液;④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。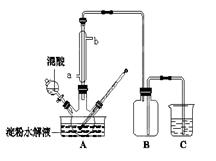
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O 3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是: 。
(2)冷凝水的进口是 (填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其
原因是 。
(3)检验淀粉是否水解完全所用的试剂为 。
(4)草酸重结晶的减压过滤操作中,除烧杯,玻璃棒外,还必须使用属于硅酸盐材料的仪器有
(5)当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,发生的化学反应方程式为: 。
(6) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为 。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三12月月考化学试卷(解析版) 题型:计算题
(15分)淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;②将一定量的淀粉水解液加入三颈烧瓶中;③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3、98%H2SO4的质量比为2:1.5)溶液;④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O 3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是: 。
(2)冷凝水的进口是 (填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其
原因是 。
(3)检验淀粉是否水解完全所用的试剂为 。
(4)草酸重结晶的减压过滤操作中,除烧杯,玻璃棒外,还必须使用属于硅酸盐材料的仪器有
(5)当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,发生的化学反应方程式为: 。
(6) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时滴定终点的现象为 。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为 。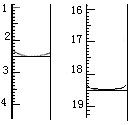
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)HNO3是极其重要的化工原料。工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的。(1)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失)。
① 试写出上述反应的化学方程式。
② 设循环操作的次数为n,试写出NO2→HNO3转化率与循环操作的次数n之间关系的数学表达式。
③ 计算一定量的二氧化氮气体要经过多少次循环操作,才能使95%的二氧化氮转变为硝酸?
(2) 上述方法制备的HNO3为稀硝酸,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围为:H2:c<6.6 mol/L;N2和NH4+:c<10 mol/L;NO:0.1 mol/L<c<10 mol/L;NO2:c>0.1 mol/L。各气相产物成分及含量随HNO3浓度变化曲线如下图所示。
④ 写出Mg与11 mol/L的HNO3反应的方程式;
⑤ 960 mg Mg与一定体积4 mol/L的HNO3恰好完全反应,收集到224 mL气体(S.T.P)气体,试通过计算写出反应方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
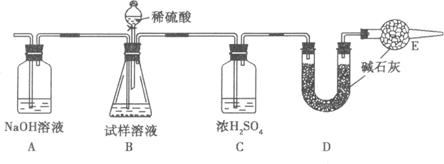
(1)测定实验的步骤为_________。(填序号)
①称量盛有碱石灰的干燥管D的质量为m1g;②称量n g纯碱样品,将其放入锥形瓶内;③按装置图组装仪器,并检查气密性;④再次称量干燥管D的总质是为m2g;⑤从分液漏斗注入一定量的稀硫酸,直到B中不再产生气体为止。再缓缓鼓入空气一段时间。
(2)在用托盘天平称量样品时,如果天平的指针向右偏转,说明_________。
(3)装置E的作用是___________________________,步骤⑤中“缓鼓人空气一段时间”的原因是_____________________________________________________________________。
(4)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填“偏高”“偏低”或“不变”)。
(5)该试样中纯碱的质量分数的计算式为____________________________________。
(6)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法
____________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com