
【题目】第19届亚洲运动会将于2022年在杭州举行,杭州的空气与水质量的提高越来越成为人们关注的问题。其中,烟气中的NOx与水中总氮含量(包括有机氮及NO3-、NO2-、NH4+等无机氮)都必须脱除(即脱硝)后才能排放。请回答下列问题:
I.空气的脱硝处理:
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1= -890.3.kJ· mol-1
N2(g)+O2(g)=2NO(g) ΔH2= +180.kJ· mol-1
(1)CH4可用于脱硝,其化学方程式为CH4(g)+4NO(g)![]() CO2(g)+2N2(g)+2H2O(l),ΔH=____kJ· mol-1。在恒温,恒容的密闭容器中通入2mol CH4和4mol NO,下列说法正确的是____。
CO2(g)+2N2(g)+2H2O(l),ΔH=____kJ· mol-1。在恒温,恒容的密闭容器中通入2mol CH4和4mol NO,下列说法正确的是____。
A.甲烷过量,可将NO完全转化为N2
B.从反应开始到平衡的过程中,NO的转化率一直增大
C.反应过程中,容器中的压强保持不变
D.平衡后,再通入一定量的甲烷,正反应速率增大
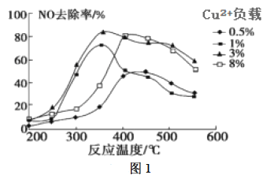
(2)C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是____。

II.水的脱硝处理:
(3)水中的含氮物质在好氧硝化菌的作用下有如下反应:
2NH4+(aq)+3O2(g)=2NO2-(aq)+4H+(aq)+2H2O(l)(快反应)
2NO2-(aq)+O2(g)=2NO3-(aq)(慢反应)
20℃时含氮废水(以NH4+)的NH4+的浓度随DO(水体中溶解氧)浓度的变化曲线如图2所示,在图2上画出20℃时NO2-的浓度随DO的变化趋势图。_______
(4)研究表明,用电解法除去氨氮废水(反应中视为NH4+)有很高的脱氮(转化为N2)效率,写出该过程中阳极的电极反应式____。
【答案】-1250.3 BD 3%、350℃左右  2NH4+-6e-=N2+8H+
2NH4+-6e-=N2+8H+
【解析】
(1)根据盖斯定律分析解答;A.可逆反应中反应物不能完全转化为生成物;B.从反应开始到平衡的过程中,NO的物质的量一直在减少;C.反应过程中,气体总物质的量减少;D.再通入一定量的甲烷,反应物浓度增大;
(2)根据图像找出NO去除率最高时对应的温度和催化剂中Cu2+负载量;
(3)由题给信息可知,生成NO2-的反应较快,后逐渐被氧化生成NO3-,NO2-浓度先增大后减小;
(4)阳极发生氧化反应,NH4+被氧化生成氮气。
I.(1)根据盖斯定律求解,CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H= -890.3kJmol-1①;N2(g)+O2(g)═2NO(g) △H= +180kJmol-1②;CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l) △H3③;则③=①-②×2,△H3=△H1-2△H2= -890.3-2×(+180)=-1250.3kJ;
A.可逆反应中反应物不能完全转化为生成物,所以NO不能完全反应,故A错误;B.从反应开始到平衡的过程中,NO的物质的量一直在减少,则NO转化率一直增大,故B正确;
C.反应过程中,气体总物质的量减少,气体压强与物质的量成正比,所以压强减小,故C错误;
D.平衡后,再通入一定量的甲烷,反应物浓度增大,浓度越大,反应速率越快,则正反应速率加快,故D正确;故选BD;
(2)由图1可知在350℃左右,催化剂中Cu2+负载量为3%时,NO去除率最高;
(3)由题给信息可知,生成NO2-的反应较快,后逐渐被氧化生成NO3-,NO2-浓度先增大后减小,则图像为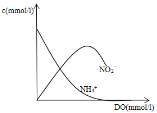 ;
;
(4)阳极发生氧化反应,NH4+被氧化生成氮气,电极方程式为2NH4+-6e-=N2+8H+。


科目:高中化学 来源: 题型:
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置看,图中尚缺少的一种玻璃用品是_______________。
(2)两烧杯间填满碎纸条的作用是________________________。
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),中和热__________(填“相等”或“不相等”),理由是_____________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会____________(填“偏大”、“偏小”或“无影响”)。
(5)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:

(1)以下叙述中,正确的是_______________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中![]() 向铜片方向移动
向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为___________;乙为______。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极:____,总反应:___。当电路中转移0.25 mol电子时,消耗负极材料的质量为_____g(Zn的相对原子质量65)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。实验室常用CaCO3为原料制备过氧化钙,流程如图:
![]()
下列说法不正确的是
A. 逐滴加入稀盐酸后,将溶液煮沸的作用是除去溶液中多余的CO2
B. 加入氨水和双氧水后的反应为:CaCl2+2NH3·H2O+H2O2=CaO2↓+2NH4Cl+2H2O
C. 生成CaO2的反应需要在冰浴下进行的原因是温度过高时过氧化氢分解
D. 产品依次用蒸馏水、无水乙醇洗涤,其中乙醇洗涤的目的是为了除去晶体表面的NH4Cl杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示有关的一种反应物或生成物(某些物质已经略去),常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出下列各物质的化学式:X:______A:______C:______F:______。
(2)写出下列变化的化学方程式:
X![]() :______;
:______;
C→E:______;
F→G:______;
(3)检验X中阳离子的方法:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取4.64g铁屑(含有Fe2O3、CuO杂质),加入足量的稀硫酸溶解,产生标准状况下气体V mL,过滤后得到0.64g残渣和滤液M(无Cu2+)。在滤液M中加入足量NaOH溶液过滤残渣充分灼烧得到4.80g固体。请计算:
(1)滤液M中存在的金属阳离子有____。
(2)参与反应的硫酸的物质的量为___mol。
(3)V=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是( )

A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能用于做喷泉实验
C.HCl、NH3和SO2均能用该装置做喷泉实验
D.用NO2和N2O4的混合气体做喷泉实验,烧瓶中将充满稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙两个恒容的密闭容器中进行下列两个可逆反应:甲容器中![]() ;乙容器中
;乙容器中![]() 。现有下列状态:①混合气体的平均相对分子质量不再改变;②恒温时,气体压强不再改变;③各气体的浓度相等;④反应体系中温度保持不变(假设为绝热容器);⑤相同时间内,断裂H—O键的速率是断裂H-H键速率的2倍;⑥混合气体密度不变;⑦单位时间内,消耗水蒸气的质量与生成氢气的质量之比为9:1。其中能表明甲、乙两容器中反应都达到平衡状态的是( )
。现有下列状态:①混合气体的平均相对分子质量不再改变;②恒温时,气体压强不再改变;③各气体的浓度相等;④反应体系中温度保持不变(假设为绝热容器);⑤相同时间内,断裂H—O键的速率是断裂H-H键速率的2倍;⑥混合气体密度不变;⑦单位时间内,消耗水蒸气的质量与生成氢气的质量之比为9:1。其中能表明甲、乙两容器中反应都达到平衡状态的是( )
A. ①②B. ③④⑥C. ⑥⑦D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍 ,下列说法中不正确的是( )
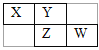
A. 单质Y的氧化性强于X
B. Y和Z具有相同的最高正化合价
C. W的单质常温呈气态
D. X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com