
【题目】某同学设计一个电池(如图所示),探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
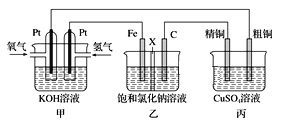
(1)通入氢气的电极为________ (填正极或负极),该电极反应式为________。
(2)石墨电极为________ (填阳极或阴极),乙中总反应离子方程式为________;如果把铁电极和石墨电极交换,乙溶液左侧出现的现象是__________________________________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01mol O2,丙中精铜增重_________克。
【答案】负极 H2-2e-+2OH-=2H2O 阳极 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 溶液中有气泡逸出,起初产生白色沉淀,然后白色沉淀迅速转化为灰绿色,最后转化为红褐色 减小 1.28g
2OH-+H2↑+Cl2↑ 溶液中有气泡逸出,起初产生白色沉淀,然后白色沉淀迅速转化为灰绿色,最后转化为红褐色 减小 1.28g
【解析】
(1)甲池为原电池,乙、丙池为电解池,甲池中燃料作负极,氧化剂作正极,书写电极反应式,
(2)书写电解饱和食盐水的离子方程式,再利用阳极是活泼金属电极则金属失去电子进行分析,
(3)电解精炼铜时粗铜作阳极,先是比铜活泼的金属失去电子,阴极是铜离子得到电子,致使溶液中铜离子浓度减小,
(4)根据关系式计算铜的物质的量,再计算质量。
(1)甲池为原电池,乙、丙池为电解池,H2作负极,O2作正极,因此通入氢气的电极为负极,该电极反应式为H2-2e-+2OH-=2H2O,
故答案为:负极;H2-2e-+2OH-=2H2O;
(2)C连的是正极,因此C电极为阳极,乙是电解饱和食盐水,其总反应离子方程式为2Cl-+2H2O![]() 2OH-+ H2↑+ Cl2↑;如果把铁电极和石墨电极交换,铁电极失去电子变为亚铁离子,阴极石墨电极氢离子放电生成氢气,同时阴极附近产生氢氧根,X为阳离子交换膜,则右侧的亚铁离子进入左侧与氢氧根离子生成氢氧化亚铁沉淀,氢氧化亚铁最终被氧化成红褐色的氢氧化铁,因此乙溶液左侧出现的现象是溶液中有气泡逸出,起初产生白色沉淀,然后白色沉淀迅速转化为灰绿色,最后转化为红褐色,
2OH-+ H2↑+ Cl2↑;如果把铁电极和石墨电极交换,铁电极失去电子变为亚铁离子,阴极石墨电极氢离子放电生成氢气,同时阴极附近产生氢氧根,X为阳离子交换膜,则右侧的亚铁离子进入左侧与氢氧根离子生成氢氧化亚铁沉淀,氢氧化亚铁最终被氧化成红褐色的氢氧化铁,因此乙溶液左侧出现的现象是溶液中有气泡逸出,起初产生白色沉淀,然后白色沉淀迅速转化为灰绿色,最后转化为红褐色,
故答案为:阳极;2Cl-+2H2O![]() 2OH-+ H2↑+ Cl2↑;溶液中有气泡逸出,起初产生白色沉淀,然后白色沉淀迅速转化为灰绿色,最后转化为红褐色;
2OH-+ H2↑+ Cl2↑;溶液中有气泡逸出,起初产生白色沉淀,然后白色沉淀迅速转化为灰绿色,最后转化为红褐色;
(3)如果粗铜中含有锌、银等杂质,阳极开始是锌放电,锌反应完再是铜失电子,而阴极始终是铜离子得到电子,因此丙装置中反应一段时间,硫酸铜溶液浓度将减小,
故答案为:减小;
(4)根据电子守恒,得关系式2Cu ~O2
根据关系得出铜的物质的量为0.02 mol,质量m = nM = 0.02 mol×64gmol-1 = 1.28g
故答案为:1.28g。


科目:高中化学 来源: 题型:
【题目】向100mL含HCl的AlCl3溶液中逐滴加入0.1mol·L-1的NaOH溶液,加入NaOH溶液的体积V(mL)与产生Al(OH)3沉淀的物质的量n(mol)的关系如图:

试计算:(请写出运算过程)
(1)原溶液中HCl的物质的量浓度。____________
(2)原溶液中AlCl3的物质的量浓度。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:Na2O+2CO Na2CO3+C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
Na2CO3+C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是
A.石墨烯与金刚石互为同素异形体
B.该生产石墨烯的反应中CO只体现了还原性
C.Na2O属于碱性氧化物,Na2CO3属于盐
D.自然界中碳元素有游离态和化合态两种存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是(部分夹持装置已略去)
A.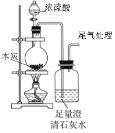 验证木炭和浓硫酸反应生成CO2
验证木炭和浓硫酸反应生成CO2
B.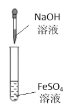 实验室制备Fe(OH)2并能较长时间观察到白色固体
实验室制备Fe(OH)2并能较长时间观察到白色固体
C.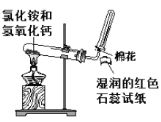 实验室制备和收集氨气并验满
实验室制备和收集氨气并验满
D.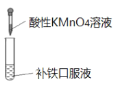 证明补铁口服液中存在+2价的铁
证明补铁口服液中存在+2价的铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的lg![]() 。25℃时,用0.100molL-1的NaOH溶液滴定20.00mL 0.100molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
。25℃时,用0.100molL-1的NaOH溶液滴定20.00mL 0.100molL-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
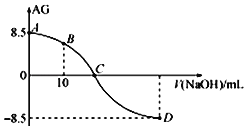
A. D点溶液的pH=11.25
B. C点之前溶液显碱性,C点之后溶液显酸性
C. C点时,加入NaOH溶液的体积为20mL
D. 25℃时,HNO2的电离常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示实验装置探究铜丝与过量浓硫酸的反应。
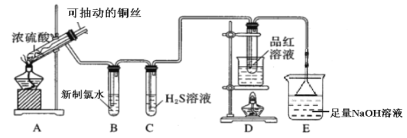
(1)写出A中发生反应的化学方程式__________。在此反应中,浓硫酸表现出来的性质有__________。(填字母序号)
A.强氧化性 B.酸性 C.吸水性 D.脱水性
(2)一段时间后,观察到B中溶液黄绿色褪去,B中反应的化学方程式为__________。C中的实验现象为__________。
(3)D中的实验现象是__________,一段时间后,点燃D处酒精灯,可以观察到__________。
(4)E装置中NaOH溶液的作用是__________。
(5)研究小组认为可以用H2O2溶液来验证E中溶液含有SO32-,进行了实验i。
实验序号 | 操作 | 现象 |
i | a. 取少量E中溶液,向其中加入适量H2O2溶液,振荡,观察。 | 无明显现象 |
b. 然后滴加__________,振荡,观察。 | 无明显现象 | |
c. 再滴加__________,振荡,观察。 | 白色沉淀 |
通过实验i可证明E中溶液含有SO32-,写出操作b、c中滴加的试剂是__________、__________。
(6)研究小组反思实验方案i不够严谨,设计了对比实验,证明了E中含有SO32-。该对比实验方案是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu的单质和合金在生活、生产中有着广泛的应用。回答下列问题:
(1)Cu的基态原子价电子排布式为___。
(2)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___,反应的化学方程式为___。
(3)配离子Cu(CN)32-中,中心离子的杂化类型是___,该配离子的空间构型为___;CN-中配位原子是___(填名称)。
(4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
①该晶胞中Ca有___个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是___pm,设NA为阿伏加德罗常数的值,CaCu晶体的密度是___g/cm3(用含m、n的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时下列物质的溶度积
CH3COOAg | AgCl | AgCrO4 | AgS | |
Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是( )
A.等体积浓度均为0.02molL-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.浓度均为0.01molL-1的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀
C.在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式:CH3COOAg+H++C1-=CH3COOH+AgCl
D.298K时,上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com