
(Ⅰ)甲取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则样品①合金中镁的质量分数为_____________。
(Ⅱ)乙取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m2 g。则样品②合金中镁的质量分数为_____________。
(Ⅲ)丙取样品③m3 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则样品③中m3的取值范围是____________________________________________。
(Ⅳ)丁取不同质量的样品④分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
实验序号 | a | b | c |
合金质量/mg | 510 | 765 | 918 |
气体体积/mL | 560 | 672 | 672 |
求:(1)该盐酸的物质的量浓度。
(2)样品④中合金中镁的质量分数。
(3)在c组实验后,还需向容器中加入1.0 mol·L-1的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
(Ⅰ)47.06%
(Ⅱ)60%
(Ⅲ)0.80V<m<1.07V或27V/33.6<m<24V/22.4或9V/11.2<m<3V/2.8
(Ⅳ)(1)丙中盐酸反应完全,n(H2)=0.672L/22.4 L·mol-1=0.03 mol
则c(HCl)=0.03 mol×2/0.03 L=2.0 mol·L-1
(2)设合金中Mg、Al的物质的量分别为x、y,则有:

求得x=y=0.01 mol,则w(Mg)=[(0.01 mol×24 g·mol-1)/0.510 g]×100%=47.06%
(3)根据HCl—NaCl和Al—NaAlO2可知
n(NaCl)=n(HCl)=2.0 mol·L-1×0.030 L=0.06 mol
n(NaAlO2)=n(Al)=0.01 mol×918/510=0.018 mol
根据Na+守恒得:n(NaOH)=0.06 mol+0.018 mol=0.078 mol
所以V(NaOH)=0.078 mol/1.0 mol·L-1=0.078 L=78 mL
c组实验后还需加入78 mL的氢氧化钠溶液,才能使剩余合金中的铝恰好完全溶解。(其他合理解法同样给分)
解析:(Ⅰ)由题意MgAl合金质量等于Al2O3质量,故Mg质量分数为Al2O3中氧的质量分数。
(Ⅱ)Mg—Al合金质量等于MgO的质量,Mg的质量分数为MgO中Mg的质量分数。
(Ⅲ)若全为Al,2Al — 3H2
54 3
m1 ![]()
m1=![]()
若全为Mg,Mg—H2
24 1
m1 ![]()
m1=![]()
故![]() <m1<
<m1<![]()
(Ⅳ)(1)图表知丙中HCl完全反应根据HCl计算2HCl—H2
(2)a中金属不足,应据a计算镁、铝质量,设两个未知数,质量和为510 mg,产生H2为560 mL解出Mg、Al物质的量。
(3)根据原子守恒n(NaCl)=n(HCl),n(NaAlO2)=n(Al),然后所有Na+均由NaOH提供,故n(NaOH)=n(HCl)+n(Al)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (2010?顺义区一模)A、B、C、D、E为短周期元素,其原子序数依次增大.其中,A元素原子半径最小;B元素原子的电子总数与最外层电子数之比为3:2;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲.A、E同主族,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.请回答:
(2010?顺义区一模)A、B、C、D、E为短周期元素,其原子序数依次增大.其中,A元素原子半径最小;B元素原子的电子总数与最外层电子数之比为3:2;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲.A、E同主族,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.请回答: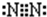
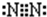
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:



 或
或
 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解




查看答案和解析>>
科目:高中化学 来源: 题型:
0:有四种质量比可能相同或不同的镁铝合金样品①、②、③、④。甲、乙、丙、丁四同学各取一种样品,进行下列实验,求合金中镁的质量分数。
(I)甲取样品①m1g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1g。则合金中镁的质量分数为_______________________。
(II)乙取样品②m2g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m2g。则合金中镁的质量分数为_______________________。
(III)丙取样品③m3g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为VL,则m3的取值范围是___________________。
(IV)丁取不同质量的样品④分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
实验序号 | a | b | c |
合金质量(mg) | 510 | 765 | 918 |
气体体积( mL) | 560 | 672 | 672 |
求:(1)则盐酸的物质的量浓度;(2)合金中镁的质量分数; (3)在c组实验后,还需向容器中加入1.0 mol/L的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com