
| A.滴定实验时,锥形瓶用蒸馏水洗净后,直接盛待测液 |
| B.用100mL量筒配制100mL0.1000mol?L-1Na2CO3溶液 |
| C.用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色,则原溶液含有钠盐 |
| D.某溶液加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则原溶液含SO42- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.容量瓶使用前要烘干 |
| B.冷凝器使用时冷水既可以从上口进也可以从下口进 |
| C.分液漏斗中上层和下层液体均可以从下口流出 |
| D.用蒸发皿蒸发溶剂时要用玻璃棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在中和热测定的实验中,将氢氧化钠溶液和盐酸混合反应后的最高温度作为末温度 |
| B.检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热后,先用稀硫酸进行酸化,再加入AgNO3溶液进行检验 |
| C.为了加快过滤速度以及得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
| D.用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④⑤ | B.①③④⑤ | C.③④⑤ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
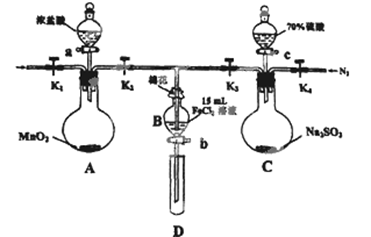
| | 过程IV B溶液中含有的离子 | 过程VI B溶液中含有的离子 |
| 甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com