
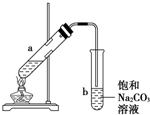
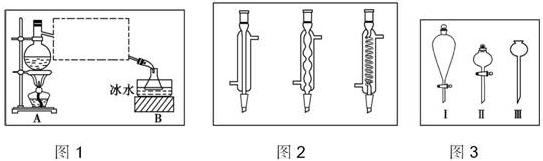
 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 可将饱和碳酸钠溶液换成氢氧化钠溶液 |
分析 先加乙醇,后加浓硫酸,最后加冰醋酸,乙醇与乙酸发生酯化反应生成乙酸乙酯,试管b中为饱和碳酸钠,可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,导管在碳酸钠溶液的液面上,可防止倒吸,长导管可冷凝回流、导气,以此来解答.
解答 解:A.向a试管中先加入乙醇,然后边摇动试管边慢慢加入冰醋酸,再加浓硫酸,防止浓硫酸溶解放热造成液体飞溅,故A正确;
B.挥发出的乙酸、乙醇易溶于水,试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象,故B正确;
C.反应加热可以提高反应速率,乙酸乙酯沸点低,加热利于蒸出乙酸乙酯,故C正确;
D.乙酸乙酯在氢氧化钠溶液中水解,不能用氢氧化钠溶液吸收,故D错误.
故选D.
点评 本题考查有机物的制备实验,为高频考点,把握物质的性质、制备原理、实验装置及实验技能为解答的关键,侧重分析与实验能力的考查,注意碳酸钠溶液及长导管的作用,题目难度不大.


科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是( )
A.Cu溶于稀HNO3:Cu+2 H++NO ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.用石墨电极电解饱和食盐水:2 Cl-+2 H2O  2 OH-+H2↑+Cl2↑
2 OH-+H2↑+Cl2↑
C.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
D.向Fe(NO3)3溶液中加入过量的HI溶液:2 Fe3++2 I-===2 Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
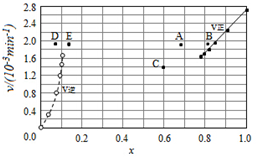 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
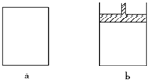 有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:
有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
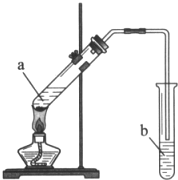 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
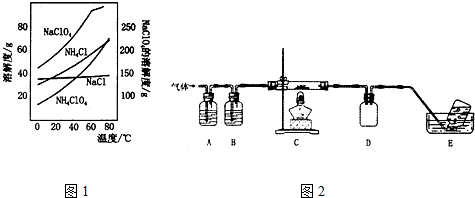
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
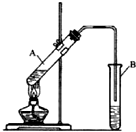 实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.
实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com