
| A. |  | B. | 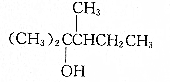 | ||
| C. |  | D. |  |
分析 有机物C7H15OH,若它的消去反应产物有三种,说明与羟基相连碳原子相邻的碳原子上含有H原子,且可以得到3种位置不同的碳碳双键,结合选项中结构进行分析判断.
解答 解:A. 发生消去反应只能得到2种烯烃,故A不符合;
发生消去反应只能得到2种烯烃,故A不符合;
B.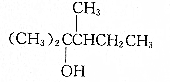 发生消去反应只能得到2种烯烃,故B不符合;
发生消去反应只能得到2种烯烃,故B不符合;
C. 发生消去反应可以得到CH2=C(CH3)CH2CH(CH3)2、(CH3)2C=CHCH(CH3)2,故C不符合,
发生消去反应可以得到CH2=C(CH3)CH2CH(CH3)2、(CH3)2C=CHCH(CH3)2,故C不符合,
D. 发生消去反应可以得到CH3CH2CH=C(CH3)CH2CH3、CH3CH2CH2C(CH3)=CHCH3、CH3CH2CH2C(CH2CH3)=CH2,故D符合,
发生消去反应可以得到CH3CH2CH=C(CH3)CH2CH3、CH3CH2CH2C(CH3)=CHCH3、CH3CH2CH2C(CH2CH3)=CH2,故D符合,
故选:D.
点评 本题考查有机物的结构与性质、醇的消去反应,比较基础,理解掌握醇发生消去反应结构特点:与羟基相连碳原子相邻的碳原子上含有H原子.


科目:高中化学 来源: 题型:选择题
| A. | 等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等 | |
| B. | 氢气与氮气能够缓慢地反应生成氨气,使用合适催化剂可以提高化学反应的转化率 | |
| C. | 用铁片与硫酸制备氢气时,滴加CuSO4溶液可以加快产生氢气的速率 | |
| D. | 二氧化硫的催化氧化反应的△H<0,所以升高温度,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O | B. | NaCl+H2SO4(浓)═NaHSO4+HCl↑ | ||
| C. | C+2H2SO4(浓)═2SO2↑+CO2↑+2H2O | D. | H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁片置于硫酸铜溶液中有铜析出 | |
| B. | 铁、铜和氯气反应分别生成FeCl3和CuCl2 | |
| C. | 足量的铁粉和铜粉与浓硫酸反应生成FeSO4和CuSO4 | |
| D. | 铜片置于FeCl3溶液中铜片逐渐溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O═2HCO3- | |
| C. | 金属Na与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | H2SO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖及其水解产物均能发生眼镜反应 | |
| B. | 可用新制Cu(OH)2,鉴别甲酸、乙醛和乙酸 | |
| C. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| D. | 淀粉和纤维素互为同分异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子从铜电极沿外电路流向锌电极 | |
| C. | 铅蓄电池的负极为PbO2,属于二次电池 | |
| D. | 锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com