
| A. | 高温低压 | B. | 低温低压 | C. | 低温高压 | D. | 高温高压 |
分析 反应A(g)+3B(g)?2C(g),△H<0,正反应是气体物质的量减小的放热反应,低温高压平衡正向进行;
解答 解:反应A(g)+3B(g)?2C(g),△H<0,正反应是气体物质的量减小的放热反应,
A.高温平衡逆向进行,低压平衡向气体体积增大的方向进行,故A错误;
B.低温平衡向吸热反应方向进行,平衡正向进行,低压平衡逆向进行,故B错误;
C.低温平衡正向进行,高压平衡正向进行,平衡向生成C的方向移动,故C正确;
D.高温平衡逆向进行,高压平衡正向进行,故D错误;
故选C.
点评 本题考查化学平衡移动的影响因素等,难度中等,注意加入惰性气体对平衡的影响,恒温恒容平衡不移动,恒温恒压,体积增大,平衡向体积增大方向移动.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
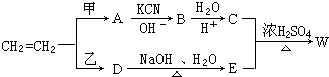
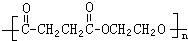 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H1=+180.5kJ/mol| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
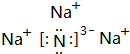 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
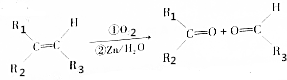
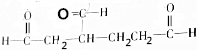 和
和 各1mol.
各1mol.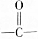 ),产物与烃分子中原子个数相等的元素有C、H.
),产物与烃分子中原子个数相等的元素有C、H. 可简写为
可简写为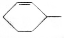 ,其中线表示化学键,线的端点、折点或交点表示碳原子,碳原子剩余的化合价用氢原子补足.写出A所有可能的结构简式:
,其中线表示化学键,线的端点、折点或交点表示碳原子,碳原子剩余的化合价用氢原子补足.写出A所有可能的结构简式: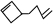 、
、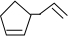 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
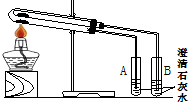 (1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.
(1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 投料比[n(NO2):n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
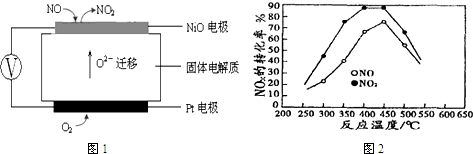
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醛的结构特点 | 可能的化学性质 |
| 有C=O双键,不饱和 | 与H2发生加成反应,乙醛表现氧化性 |
CHO中C-H键极性较强 | CHO中C-H键被氧化,变为C-OH |
| 实验 | 现象 | 结论 |
| 取适量乙醛溶液,滴加高锰酸钾酸性溶液 | 高锰酸钾溶液紫色变浅(褪去) | 乙醛能被高锰酸钾氧化 |
| 向新制银氨溶液中加入几滴乙醛溶液,水浴加热 | 试管壁上出现银镜(一层光亮如镜的银) | 乙醛将银氨溶液还原 |
| 向新制氢氧化铜悬浊液中加入适量乙醛溶液,加热 | 出现红色沉淀 | 乙醛被氢氧化铜氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com