
【题目】填空题
(1)I.比较原子半径的大小:OF;(填“>”或“<”,下同)
(2)比较酸性强弱:H3PO4H2SiO3
(3)稳定性:NH3PH3
(4)II.写出下列物质形成过程的电子式: HCl
(5)MgCl2 .
【答案】
(1)>
(2)>
(3)>
(4)H?+ ![]() →
→ ![]()
(5)![]()
【解析】解:I.(1)同周期元素从左到右,原子半径逐渐减小,则原子半径O>F,所以答案是:>;(2)非金属性P>Si,元素的非金属性越强,对应的最高价氧化物的酸性越强,所以答案是:>;(3)非金属性N>P,元素的非金属性越强,对应的氢化物越稳定,所以答案是:>;II.(4)氯化氢为共价化合物,其形成过程是:H+ ![]() →
→ ![]() ,所以答案是:H+
,所以答案是:H+ ![]() →
→ ![]() ;(5)镁原子失去最外层的2个电子形成稳定的镁离子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁,用电子式表示下列物质的形成过程为
;(5)镁原子失去最外层的2个电子形成稳定的镁离子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁,用电子式表示下列物质的形成过程为  ,
,
所以答案是:  .
.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把 0.4mol 液态肼和 0.8mol H2O2 混合反应,生成氮气和水蒸气,放出 256.7kJ 的热量(相当于 25°C、101kPa下测得的热量)。(注:所有数值均保留小数点后一位)
(1)写出肼的结构式:_____________,过氧化氢电子式_____________。
(2)反应的热化学方程式为______________________________。
(3)已知 H2O(l)=H2O(g)ΔH=+44kJ/mol.则 16g 液态肼与液态双氧水反应生成液态水时放出的热量是_________ kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图1装置,根据元素非金属性与对应最高价含氧酸之间的关系,可以一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A,B,C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、蘸有碱液的棉花.已知常温下浓盐酸与高锰酸钾能反应生成氯气. 
(1)甲同学设计实验的理论依据是;写出选用药品分别为:A , B , C;其中装置B中所盛试剂的作用为;C中反应的离子方程式为;
(2)乙同学的实验理论依据是;A处的现象是:;写出B处的离子方程式 , C处药品的作用 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是 , 生成SO2的体积为(标准状况下)mL.
(2)若题干中浓硫酸的物质的量浓度为a molL﹣1 , 投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)0.025a mol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,求原浓硫酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质名称与物质的符号不对应的是
A.消石灰:Ca(OH)2B.熟石膏:2CaSO4·H2O
C.蚁酸:CH3COOHD.硬脂酸钠:C17H35COONa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:碱存在下,卤代烃与醇反应生成醚(![]() ):
):
![]()
化合物![]() 经下列四步反应可得常用溶剂四氢呋喃,反应框图如下:
经下列四步反应可得常用溶剂四氢呋喃,反应框图如下:

![]() 、
、![]() 互为同分异构体,请回答下列问题:
互为同分异构体,请回答下列问题:
(1)![]() 和
和![]()
![]() 在一定条件下恰好反应,生成饱和一元醇
在一定条件下恰好反应,生成饱和一元醇![]() ,
, ![]() 的分子式为
的分子式为![]() ,
, ![]() 的结构简式为_________________。
的结构简式为_________________。
(2)第①③步反应类型分别为_______________反应,③_______________反应。
(3)化合物![]() 具有的化学性质(填写字母代号)是_______________。
具有的化学性质(填写字母代号)是_______________。
![]() 、可发生催化氧化反应
、可发生催化氧化反应
![]() 、与浓硫酸共热或与氢氧化钠的醇溶液共热均能发生消去反应
、与浓硫酸共热或与氢氧化钠的醇溶液共热均能发生消去反应
![]() 、可发生酯化反应
、可发生酯化反应
![]() 、催化条件下可发生加聚反应
、催化条件下可发生加聚反应
(4)核磁共振氢谱显示![]() 分子中有两种氢,写出
分子中有两种氢,写出![]() 的化学反应方程式:_______________。
的化学反应方程式:_______________。
(5)四氢呋喃(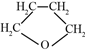 )有多种同分异构体,写出符合下列条件的结构简式____________。
)有多种同分异构体,写出符合下列条件的结构简式____________。
①链状 ②含有醚键 ③核磁共振氢谱显示有三种类型的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合是( )
分类 | A | B | C | D |
碱 | 纯碱 | 烧碱 | 苛性钠 | 苛性钾 |
酸 | 盐酸 | 硫酸 | 醋酸 | 油酸 |
盐 | 烧碱 | 食盐 | 萤石 | 苏打 |
碱性氧化物 | 氧化铁 | 氧化镁 | 过氧化钠 | 氧化钠 |
酸性氧化物 | 二氧化碳 | 一氧化碳 | 二氧化硫 | 三氧化硫 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为该电池的工作原理示意图,该电池的电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答:
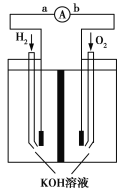
(1)氢氧燃料电池放电时能量转化形式主要是__________,在导线中电子流动方向为________(用a.b表示)。
(2)负极反应式为__________________。
(3)电极表面镀铂粉的原因为__________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.Li+H2![]() 2LiH
2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是____________。
②知LiH固体的密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③将由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上有一种加酶洗衣粉,它是在洗衣粉中加入少量的碱与蛋白酶制成的。蛋白酶的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质、油渍遇到它,都能水解而除去。下列衣料中,不能用加酶洗衣粉洗涤的是
A. 棉织品 B. 毛织品 C. 腈纶织品 D. 丝织品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com